- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
85 Cartas en este set
- Frente
- Atrás
|
¿Quién es Hefesto?
|
Es el dios griego del fuego, metales y metalurgia
|
|
¿Quién es Vulcano?
|
Es el dios romano del fuego y herrero de los dioses
|
|
¿Cómo se veía a la metalurgia en la antigüedad?
|
Como un arte.
|
|
¿Desde qué año se comenzó a usar el oro?
|
Desde el 3500 AC
|
|
¿Desde que año extraían los egipcios el hierro del mineral y conocían las propiedades del acero?
|
Desde 1000 AC
|
|
¿De qué forma fue la investigación de la estructura de los materiales hasta siglo XIX y por qué?
|
Fue macroscópica porque…
|
|
¿A qué se dedicó y quién era Henry Clifton Sorby?
|
Se dedicó al estudio de los metales (Metalografía)
|
|
¿Qué hizo Albert Sauver para mejorar la investigación de los metales?
|
Implemento el uso del microscopio en el siglo XX para el estudiar los metales.
|
|
¿Cómo se estudia hoy en día a los metales?
|
A partir de los rayos X y la mecánica cuántica.
|
|
¿Cómo se clasifican los materiales de forma general? 6
|
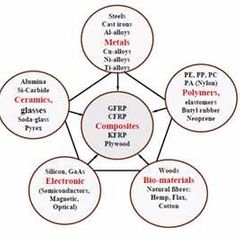
1, Metales (hierro fundido, Aleaciones de Cu-Ni-Ti…)
2, Cerámicos (Vidrios, Alumina, Pyres…?) 3, Polímeros (PE, PP, PA) 4, Biomateriales (Fibras naturales, algodón) 5, Electronicos (Silicio, GaAs) 6, Compuestos (GFRP, CFRP, Plywood) |
|
¿Cómo se clasifican los materiales según su función? 9
|

|
|
¿Cuáles son los 4 aspectos del estudio de un material?
|
Costo, Composición, Síntesis-Proceso y Microestructura
|
|
¿Qué es un compuesto químico?
|
Es cualquier sustancia formada por la unión de dos o más tipos de elementos químicos
|
|
¿A qué hace referencia el polimorfismo en los materiales? De un ejemplo
|
Es la capacidad de un material de existir en más de una forma o estructura cristalina. Ocurre solo en compuestos químicos. Además, describe las diferencias en las estructuras cristalinas de los compuestos.
EJEMPLO: O2 y O3 |
|
¿De qué depende la estructura cristalina?
|
De la presión y de la temperatura.
|
|
¿Qué conllevan consigo las transformaciones polimórficas de los materiales?
|
Van acompañados de cambios de densidad y propiedades físicas.
|
|
¿Qué es la alotropía?
|
Es la existencia de dos o más formas físicas diferentes de un elemento químico. Ocurre solo en elementos químicos. Además, describe las diferencias en la disposición de los atomos en los materiales del mismo elemento químico.
|
|
¿Qué estructuras componen la alotropía del hierro?
|

|
|
De 4 ejemplos de la alotropía del carbon
|
Diamante
Grafito Grafeno Fulereno |
|
¿Qué es la forja?
|
Es e proceso mecánco mediante el cuál se le da forma a los metales.
|
|
¿Cuáles son los enlaces primarios?
|
Ionico, Covalente y Metálico.
|
|
¿Cómo se produce el enlace iónico?
|
Se produce por la transfencia de electrones de un átomo a otro debido a la diferencia de electronegatividad.
|
|
¿Cómo se produce el enlace covalente?
|
Por una compartición de electrones producto de la necesidad de llegar a un estado más estable.
|
|
¿Qué tipos de enlaces covalentes hay?
|

|
|
¿Cómo se produce el enlace metálico?
|
Se producen por la interacción de los electrones libres o de valencia de cada átomo metálico con los cationes de los demás átomos, estos contrarrestan la repulsión entre catión y catión.
|
|
¿De qué son responsables los electrones libres en los metáles?
|
De mantener los enlaces y de la conductividad térmica y eléctrica de estos.
|
|
¿Cuáles son los enlaces secundarios?
|
Fuerzas de Van der Waals.
Puentes de hidrogeno. |
|
¿Qué son las fuerzas de Van der Waals?
|
Son fuerzas débiles de atracción entre dipolos que pueden ser inducidos o permanentes.
|
|
¿Cómo funcionan los dipolos inducidos de las fuerzas de Van der Waals?
|

|
|
¿Cómo funcionan los dipolos permanentes de las fuerzas de Van der Waals?
|
Se crean en las moléculas que ya son polares, los dipolos se orientan para atraerse con el polo de signo contrario de la molécula vecina, son mas fuertes que los inducidos.
|
|
¿Cómo se generan los puentes de hidrogeno?
|
Ocurren cuando un átomo de hidrogeno se enlaza a un átomo fuertemente electronegativo como Nitrógeno, Oxigeno o el Flúor.
|
|
¿Qué tipos de materiales solidos hay?
|
Amorfos y Cristalinos.
|
|
¿Qué es un material solido amorfo?
|
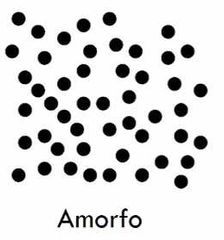
Son los que no cristalizan y mo tienen un orden de largo alcance.
|
|
¿Qué es un material solido Cristalino y qué tipos hay?
|

Son en los que los átomos se situan en una disposición repetitiva a lo largo de muchas distancias atómicas (orden de largo alcance)
Los hay monocristalinos y policristalinos. |
|
¿Para qué es el modelo atómico de esferas rigidas?
|
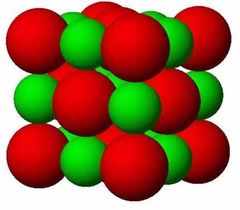
Para describir las estructuras cristalinas considerando a los átomos o iones como esferas solidas con diametros bien definidos.
|
|
¿Qué es una Red cristalina?
|
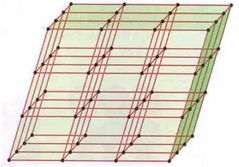
Es una disposición tridimensional de puntos para designar la posición de los componentes (átomos, iones o moléculas).
|
|
¿Qué es una celda unitaria?
|

Es la unidad más pequeña que se repite en una red cristalina.
|
|
¿Con respecto a qué parametros se clasifican las redes cristalinas?
|
Segun la configuración de la celda unitaria (Parámetros de red).
Segun la disposición de los átomos. |
|
¿Cuáles los parámetros de red que me dan la configuración de la Celda?
|
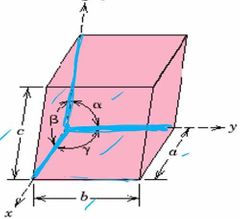
1, Longitud de las aristas (a, b y c).
2, Ángulos interaxiales (alfa, beta y gama). |
|
¿Cuáles son los 7 sistemas cristalinos que crean las distintas combinaciones de los parámetros de red?
|
1, Cúbico.
2, Tetragonal. 3, Hexagonal. 4, Ortorrombico. 5, Romboédrico o trigonal. 6, Monoclínico. 7, Triclínico. |
|
¿Cómo se divide un sistema cristalino?
|
En
P: Primitiva los átomos están en los vertices. F: Centrada en las caras. B: Centrada en el cuerpo. C: primitiva doblemente centrada en el cuerpo. |
|
¿Cuáles son las estructuras cristalinas mas comunes?
|
1, Cúbica centrada en las caras (FCC)
2, Cúbica centrada en el cuerpo (BCC) 3, Hexagonal conpacta (HCP) |
|
¿Cuáles son las 14 redes de Bravais que se forman a partir de los sistemas cristainos?
|
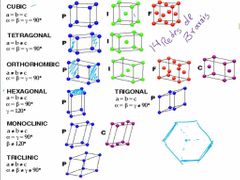
1, Cúbico (P, B, F)
2, Tetragonal (P, B) 3, Hexagonal (P) 4, Ortorrómbica (P, B, F, C) 5, Trigonal (P) 6, Monoclínica (P, C) 7, Triclínica (P) |
|
¿Cómo hallas el Factor de empaquetamiento de una estructura cristalina?
|

Con la formula:
|
|
¿Cómo se calcula la densidad atómica de una sustancia?
|

Con la formula:
|
|
¿Qué es una dirección Cristalográfica?
|
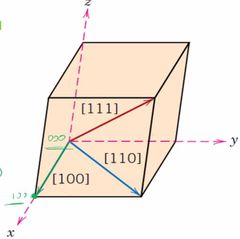
Es una linea que se define por una linea entre 2 puntos o por un vercor conveniente.
|
|
¿Qué es una familia de direcciones en los cristales cúbicos?
|
Son todas las direcciones que tienen los mismos indices, sin tener en cuenta el orden o signo, son equivalentes, ejemplo:
<1 2 3> <•2 1 •3> |
|
¿Qué es el número de coordinación?
|
Es la cantidad de átomos que tocan a determinado átomo (número de vecinos mas cercanos que tiene determinado átomo).
|
|
¿Qué tipos de sistemas de coordenas hay y por qué?
|
Sistema Miller y Miller-Bravais debido a que algunas direcciones cristalograficas de los cristales de simetría hexagonal no tienen el mismo conjunto de indices.
|
|
¿Qué es la densidad atómica lineal?
|
Es la fracción de longitud de linea, de una dirección cristalográfica particular, que pasa a través de los centros de los átomos.
|
|
¿Qué es la densidad atómica planar?
|
Es la fracción del área del plano cristalográfico ocupado por átomos, el plano pasa a través del centro del átomo para que este se pueda incluir.
|
|
¿Cuáles son las equivalencias para pasar de sistema Miller a Miller-Bravais?
|

|
|
¿Qué es número de vacancia (Nv) y cómo lo hallas?
|

Es el número de huecos que posee una estructura en un determinado volumen.
. |
|
¿Qué es un defecto de Frenkel?
|

Es una combinación vacancia-intersticio, que ocasiona expansiones localizadas.
|
|
¿Qué es un defecto de Schottky?
|

Es un par de vacancias de iones de carga opuesta.
|
|
¿Qué es un defecto sustitucional?
|
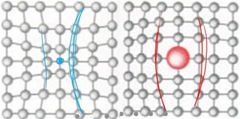
Es la sustitución de un átomo por otro.
Se rompe el orden y aparece un elemento diferente en la estructura |
|
¿Qué es una solución solida?
|
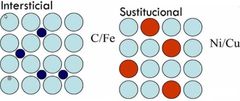
Es un material solido que se conforma por los atomos de un elemento en mayor cantidad (Solvente) y uno en menor cantidad (Soluto)
|
|
¿Qué son los defectos de Vacancia?
|

Son huecos creados por la pérdida de un átomo que se encontraba en esa posición.
. |
|
¿Qué son los defectos intersticiales?
|
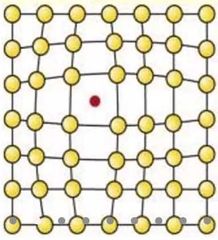
Es cuando los átomos de una inpureza llenan los vacios dentro del material original.
. |
|
¿A cuánto equivale el valor de C en un sistema HCP?
|
a 1.633*A
|
|
¿Qué son los Defectos de Línea?
|
Son dislocaciones, es decir, imperfecciones lineales en una red.
|
|
¿Cuando ocurren los defectos lineales?
|
Se introducen en la red durante el proceso de solidificación del material o al deformarlo.
|
|
¿En qué materiales ocurren los defectos lineales y para que sirven?
|
En todos los materiales, son de utilidad para explicar la deformación o el endurecimiento en los metáles.
|
|
¿Qué es una dislocación de borde o línea?
|
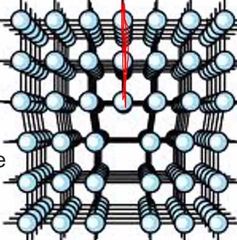
Es cuando una porción extra de un plano de átomos, o semi plano termina dentro del cristal.
El borde inferior de este plano repeesenta la dislocación. |
|
¿Qué es una dislocación Helicoideal y cómo se forma?
|
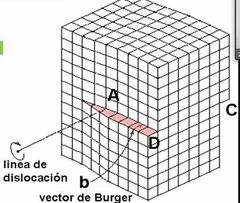
Es cuando una región del cristal se desliza con respecto su región vecina.
Se forma al aplicar un esfuerzo cortante. |
|
¿Qué es una dislocación mixta?
|
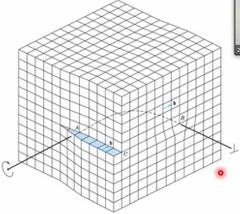
Es la que tiene componentes tanto del defecto de borde como del defecto helicoideal (tornillo) con una región de transacción entre ambas.
|
|
¿Qué son los defectos Planares o Interfaciales?
|
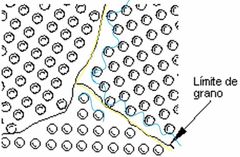
Son límites de grano que tienen dos direcciones y normalmente separan regiones del material que tienen diferente estructura cristalina y/o orientación cristalográfica. (amarillo)
|
|
¿Qué es la supercie externa?
|
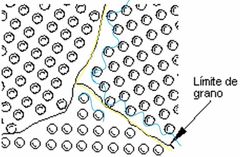
Representa el límite de la estructura cristalina, donde termina.
Los átomos superficiales no están enlazados con el máximo de vecinos próximos. (azul) |
|
¿Qué caracteríza a los átomos de la superficie externa?
|
Están en un estado energético superior que los átomos interiores.
|
|
¿Qué tipos de límite de grano hay?
|
De ángulo grande y pequeño.
|
|
¿Cuando se generan los límites de grano pequeños?
|
Se generan al alinearse las dislocaciones del borde.
|
|
¿Qué es el límite de macla?
|
Es un tipo especial de límite de grano a través del cuál existe un simetría de red espectacular.
|
|
¿Cómo se genera un límite de macla?
|
Se genera por desplazamientos atómicos producidos al aplicar fuerzas mecánicas cizallantes (BBC y HC) y durante tratamientos térmicos de recocido posteriores a la deformación (FCC).
|
|
¿Qué tipos de defectos extendidos o de volumen hay?
|
Poros
Grietas Inclusiones |
|
¿Cómo son los defectos de poros?
|
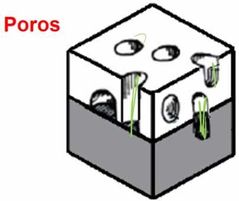
Son huecos en la estructura cristalina.
|
|
¿Cómo son los defectos de grietas?
|
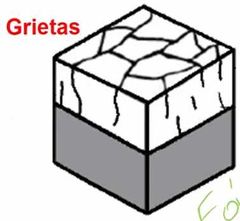
Son defectos extendidos de grietas que se forman por la fatiga en el material.
|
|
¿Cómo es la formula del tamaño de grano y cuál es su indice de tamaño?
|
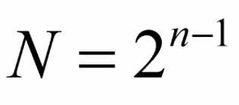
indice : 100X
|
|
¿Cómo es la fórmula de la Ley de Bragg?
|
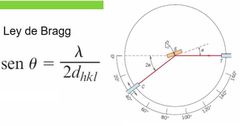
|
|
¿Por qué son importantes las densidades lineales y planares?
|
Porque explican los deslizamientos, que son el fundamento del mecanismo de plasticidad de los metáles.
|
|
¿Dónde ocurren los deslizamientos usualmente?
|
En los planos cristalinos de máximo empaquetamiento a lo largo de las direcciones que tienen el mayor empaquetamiento.
|
|
¿Qué es un defecto reticular? De ejemplos
|
Son defectos en las estructura de la red, ejemplos:
Gemas -Diamantes azules deben su color a impurezas de boro (ppm) -Esmeraldas deben su color a impurezas de Cr+3 (ppm) |
|
¿Qué propiedades de los metáles afecta los defectos reticulares?
|
La ductilidad, dureza, frajilidad, conductividad, etc.
(Son efectos drásticos) |
|
¿Cómo se dividen los defectos reticulares según sus dimensiones?
|
0D Defecto Puntuales
1D Defectos Lineales 2D Defectos Planares 3D Defectos Extendidos |
|
¿Qué tipos de defectos puntuales hay?
|
Vacancias
Intersticiales Schottky Frenkel Sustitucional |
|
¿Cómo se crea una vacancia?
|
Se crean cuando los átomos se trasladan cambiando su posición con sus vecinos, sobre todo a altas temperatura.
|