- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
48 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
Leyes ponderales
|
-Ley de la conservación de la masa
-Ley de las proporciones definidas -Ley de las proporciones múltiples |
|
|
Ley de la conservación de la masa o de la materia
|
La masa total de los reactivos que reaccionan es igual a la masa total de los productos de la reacción. La materia no se crea ni se destruye, se transforma.
|
Lavoisier
|
|
Ley de las proporciones definidas
|
Establece que muestras diferentes de un mismo compuesto siempre contienen los mismos elementos en la misma proporción en masa.
|
Proust
|
|
Ley de las proporciones múltiples
|
Establece que los átomos de dos o más elementos se pueden combinar en proporciones diferentes de números sencillos para producir más de un compuesto distinto.
|
|
|
Masa Molecular (MM)
|
Suma de las masas atómicas de cada uno de los átomos que la componen.
Se mida en unidades de masa atómica, "uma" |
|
|
Mol
|
Cantidad de sustancia que contiene tantas entidades elementales como átomos hay exactamente en 12 gramos de carbono 12
|
|
|
Número de avogadro
|
6.022 x 10^23
|
|
|
Masa Molar
|
Masa en gramos de un mol de una sustancia.
gramos/mol |
|
|
Método de relación molar
|
Relación entre la cantidad de moles de las dos especies que participan en la reacción
nmola/nmolb |
|
|
Reactivó limitante
|
Reactivó que se consume primero.
|
|
|
Reactivó en exceso
|
Reactivó que sobra en una reacción química.
|
|
|
Mezcla
|
Combinaciones de dos o más sustancias en las que estas conservan sus propiedades.
|
|
|
Mezcla Heterogenea
|
Mezclas de composición no uniforme, donde es posible distinguir las distintas fases que componen esta mezcla.
|
|
|
Tipos de mezclas heterogeneas
|
-Coloides
-Suspensiones |
|
|
Suspension
|
Tipo de mezcla heterogénea, donde un sólido se dispersa en un líquido. Se observan claramente dos fases.
|
|
|
Coloide
|
Tipo de mezcla heterogénea, se encuentra en el límite de la homogeneidad. Uno de los componentes es insoluble en el otro.
|
|
|
Mezcla Homogenea
|
Mezclas de composición uniforme, nones posible distinguir una sustancia de la otra.
|
|
|
Solucion
|
Mezcla homogénea de dos o más sustancias. Se componen de soluto y solvente.
No debe haber una reacción química entre soluto y solvente. |
|
|
Nombra las clasificaciones de las soluciones
|
-Solución Ionica
-Solución Molecular -Solución Acuosa |
|
|
Solución Ionica
|
Son aquellas en que el soluto es un electrólito y el solvente es polar, constituyendo una mezcla conductora de electricidad.
|
|
|
Solución Molecular
|
Se forman entre aquellas sustancias no electrolitos y solventes apolares, las moléculas del soluto no se disocian y están rodeadas por el solvente.
|
|
|
Solución Acuosa
|
Soluciones donde el solvente es agua
|
|
|
Solubilidad
|

Corresponde a la máxima cantidad de sustancia que se puede disolver en una determinada de solvente a temperatura específica.
|
|
|
Miscible
|
Líquido soluble
|
|
|
Inmiscible
|
Líquido insoluble
|
|
|
Factor es que afectan la solubilidad
|
-Interacciones soluto disolvente
-Temperatura -Presion |
|
|
Interacciones soluto disolvente. Factor que afecta solubilidad
|
Mayor será la solubilidad si hay más interacción entre soluto y disolvente.
|
|
|
Temperatura. Factor alterante de solubilidad
|
Al aumentar la temperatura, dependiendo de los componentes, la solubilidad varía.
|
|
|
Presion. Factor alterante de solubilidad
|
A mayor presión, mayor es la solubilidad de los gases.
|
|
|
Concentración
|
Cantidad de soluto presente en una cantidad determinada de solvente o de solución
Se emplean dos tipos de unidades: físicas y químicas. |
|
|
Concentraciones Físicas. Mencionadas todas
|
Porcentaje masa/masa
Porcentaje masa volumen Porcentaje volumen/volumen |
|
|
Concentraciones Químicas. Nombralas
|
Molaridad
Modalidad Fracción Molar |
|
|
Porcentaje Masa/Masa
|
Cantidad de masa en gramos de soluto en 100 gramos de solución. No tiene unidades. La masa de la solución es: masa soluto+masa solvente.
No olvides multiplicar por 100, es un porcentaje. |
|
|
Porcentaje masa/volumen
|
Relación entre la masa del soluto y el volumen de la solución, multiplicado por 100. No tiene unidades.
|
|
|
Porcentaje volumen/volumen
|
Relación entre el volumen del soluto y el volumen de la solución, multiplicado por 100. No tiene unidades. Ambos volúmenes deben ser expresados en mililitros.
|
|
|
Molaridad (M)
|
Número de moles de soluto contenidos en cada litro de solución. Su unidad de medida es el molar.
Molaridad = Moles de soluto/litros de solución |
|
|
Molalidad (m)
|
Número de moles de soluto por kilogramos de solvente.
Su unidad de medida es el molal (m) Molalidad = Moles de soluto/Kilogramos de solvente |
|
|
Fracción Molar (X)
|
Relación entre la cantidad de moles de cada componente con la totalidad de moles de la solución.
|
|
|
Unidades de concentración para soluciones diluidas. Mencionalas
|
Partes por millón (ppm)
Partes por billon (ppb) |
|
|
Partes por millón (ppm)
|
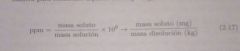
Relación entre las partes de un soluto entre un millón de partes de solución.
|
|
|
Partes por billón (ppb)
|

Relación entre partes de un soluto en un billón de partes de solución.
|
|
|
Propiedades Coligativas
|
Propiedades que dependen sólo del número de partículas de soluto en la disolución, y no en sus propiedades.
|
|
|
Propiedades Coligativas. Nombralas
|
-Disminución de la presión de vapor
-Aumentó del punto de ebullición -Disminucion del punto de congelación -Presión Osmotica |
Son 4
|
|
Disminución de la presión de vapor.
|

La explicación es muy difícil y extensa para una simple tarjetita. Buscala si se olvida, adjunto la formula
|
|
|
Aumentó en el punto de ebullición
|

Debido a la presencia de un soluto no volátil, disminuye la presión de vapor de una solución, y esto afecta también al punto de ebullición.
|
|
|
Descenso en el punto de congelación
|
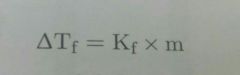
Como en una disolución hay mayor desorden que en el solvente puro, es necesario que libere más energía para generar desorden.
La fórmula es similar a la del ascenso ebulloscopico. |
|
|
Presión Osmotica
|
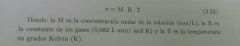
La presión osmotica de una disolución es la presión que se requiere para detener la ósmosis. Esta presión puede medirse directamente a partir de la diferencia en los niveles finales del fluido.
|
|
|
Presión Osmotica de disoluciones de electrolitos
|
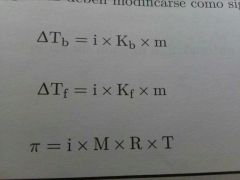
El estudio de las propiedades coligativas de electrolitos precisa un método diferente del que se utiliza para las propiedades coligativas de los no electrolitos. La razón de esto es que los electrólitos en solución se disocian en Iones, cada unidad de electrolito se disocia en dos unidades nuevas.
Factor de van't Hoff (i) = número real de partículas después de la disociación/número de unidades de fórmula inicialmente disueltas en la solución. Las letras en la fórmula representan a: (i) Factor de van't hoff, (M) Concentración Molar, (R) es la constante de los gases, (T) Temperatura en Kelvin |