- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
45 Cartas en este set
- Frente
- Atrás
|
¿Cuál es el proposito del libro?
|
Desarrollar los conceptos y metodos solución que se requieren para determinar la distribución de flujos de materia y energía en un proceso químico. (Balances de materia y energía)
|
|
¿Cuáles son las dos funciones principales de un ingeniero químico?
|
Desarrollar y diseñar procesos que conviertan materias primas y fuentes básicas de energía en productos deseados o formas superiores de energía, así como mejorar y operar procesos de la forma mas segura, confiable y económica.
|
|
¿Qué interviene en la función de diseño de un ingeniero químico?
|
La síntesis de secuencias apropiadas de etapas de transformación químicas y físicas, contando con los saberes de las condiciones necesarias.
|
|
¿Cuál es el objetivo del ingeniero químico?
|
Utilizar la información que da un químico en un laboratorio y utilizar las herramientas que crea un ingeniero mecánico o de estructuras para pasar del laboratorio a una planta comercial a gran escala y optimizar el proceso cada vez que sea posible.
|
|
¿En qué se basan y para que sirven los calculos de balance?
|
Se basan en el principio de conservación de la materia y la energía y sirven para determinar flujos, composiciones y temperaturas de las corrientes en un diagrama de flujo, contando con información suficiente.
|
|
¿Porqué son de gran importancia los balance?
|
Son necesarios para el diseño de equipos y del proceso en general.
|
|
¿Qué problemas técnicos puede presentar normalmente un IQ en su labor?
|
1, Diseño de un proceso.
2, Estudio de la disminución de producción de un proceso. 3, Cambiar el enfoque en la producción de unos compuestos, aumentar la de uno, disminuir la de otro. |
|
¿Qué podemos controlar mediante el balance?
|
1, Procesos de recirculación de sustancias.
2, Control de variables dentro de un sistema. |
|
¿Qué expone el principio de conservación de la teoría de la relatividad?
|
Expone que la suma de la masa y la energía de un sistema se conserva.
|
|
¿Qué es un sistema?
|
Una porción del universo aislado para el estudio.
|
|
¿Qué es la masa del sistema?
|
Es la cantidad de materia cuya velocidad relativa es cero con respecto a un punto de referencia seleccionado.
|
|
¿Qué es la energía del sistema?
|
Energía en todas las formas posibles que pertenecen al sistema.
|
|
¿Cómo es la ecuación que describe el principio de conservación de la materia y energía?
|
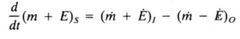
La razon de cambio de la masa y la energía del sistema es igual a la razón de salida del sistema menos la de entrada.
|
|
En ausencia de reacciones nucleares o velocidades cercanas a la luz la interconversión entre materia y energía se desprecia, por lo tanto ¿Cómo queda la ecuación de conservación?
|
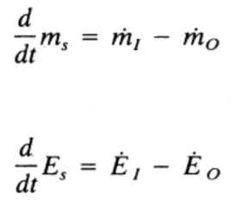
Son el principio de conservación de la materia y la energía.
|
|
Las ecuaciones de principios de conservación se presentan como funciones que cambian con el tiempo ¿Cómo se le dice a los sistemas que cambian su masa y energía a través del tiempo y cómo se le dice a los que no lo hacen?
|
, Sistema dinámico, si cambia su materia o energía a través del tiempo
, Sistema en estado estable, si su materia y energía no cambian con el tiempo. |
|
¿Qué caracteriza a un sistema en estado estable?
|
Las propiedades del sistema no cambian, por lo tanto las derivadas de la energía y la masa con respecto al tiempo, que en algunos casos se llama acumulación es igual a cero.
|
|
¿De qué otra forma se puede clasificar a los sistemas ademas se dinámicos y en estado estable?
|
En base a la ocurrencia de transferencia de masa a través de las fronteras.
, Sistema abierto , Sistema Cerra , Sistema Aislado |
|
¿Qué es un sistema abierto?
|
En un sistema en el que ocurre transferencia de masa desde o hacia el interior del mismo.
|
|
¿Qué es un sistema cerrado?
|
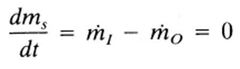
Es en el que no ocurre transferencias de masa a través de las fronteras del sistema. Donde m1 y m0 son iguales a cero, por lo tanto la ecuación de balance se reduce:
|
|
¿Un sistema cerrado es estable o dinámico con respecto a la energía?
|
Puede ser de las dos formas, ya que las propiedades que describen el sistema pueden cambiar o mantenerse constantes sin que haya un efecto en la masa.
|
|
¿Qué es un sistema aislado?
|
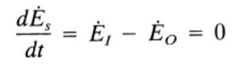
Es aislado si está cerrado y, además, no hay transferencia de energía a través de las fronteras del sistema, es decir, su flujo de energía inicial es igual al final y su ecuación de balance energético sería:
|
|
De acuerdo a la Teoría atómica ¿De qué están formados los compuestos químicos?
|
Estan formados de agregados unidos entre si llamados moléculas, que consisten de átomos de uno o de los demás de 103 elementos existentes.
|
|
Según la teoría atómica ¿Cómo son las proporciones numéricas de los átomos que conforman las moléculas?
|
Son en proporciones de enteros.
|
|
¿Qué es una reacción química?
|
Es cuando dos o más sustancias interactúan entre si para formar una o mas sustancias, en el proceso se rearreglan las moléculas reaccionantes, redistribuyendo sus elementos constitutivos para formar las moléculas de los productos deseados.
|
|
¿Cómo es la ecuación estequiometrica de reacción?
|
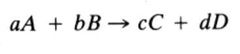
Si a moléculas del compuesto cuya fórmula molecular es A, se combina con b moléculas del compuesto B para formar c y d moléculas de los compuestos C y D, entonces la ecuación estequiometrica es:
Donde a,b,c y d son coeficientes estequiometricos La flecha indica que la reacción es irreversible en esas condiciones, de lo contrario habría dos flechas. |
|
¿Cuando se dice que una ecuación está balanceada?
|
Cuando hay el mismo número de atomos de cada elemento a ambos lados de la ecuación.
|
|
¿Cómo se relacionan las moléculas en una reacción teórica de los compuestos con las masas reales en un proceso?
|
Mediante el peso atómico, molécular o mol.
|
|
¿Qué es el peso atómico?
|
Es la masa relativa de un átomo de dicho elemento, basado en una escala estándar.
|
|
¿Qué es el peso molécular?
|
Es la suma de los productos del peso atómico de cada elemento constituyendo el número de átomos de ese elemento que están presentes en una molécula del compuesto.
|
|
¿Qué es una mol?
|
Es un conjunto que ea igual a la cantidad de entidades que tienen 12 gramos de carbono-12.
|
|
¿Qué es el número de Avogadro?
|
Es el número de átomos contenidos en un gramo mol de carbono-12.
|
|
¿Qué se necesita para la aplicación de las leyes de conservación a sistemas en estado estable?
|
De la solución de sistemas de ecuaciones de balance para determinar los valores de flujos desconocidos.
|
|
¿De qué tipos se pueden resolver las ecuaciones que se presentan en los balances?
|
1, Ecuaciones lineales.
2, Regla de Cramer. 3, Eliminación de variables. 4, metodos para resolver ecuaciones no lineales. 5, Resolución gráfica. 6, Sistemas de ecuaciones |
|
¿Qué es una cantidad dimensional?
|
Es aquella que está definida por una magnitud y el nombre de una unidad de medición.
|
|
¿Qué es un metro?
|
Es 1 650 763, 73 veces la longitud de onda en el vacío de la radiación correspondiente a la transición entre los niveles 2p10 y 5d5 del átomo de Kriptón-86.
|
|
¿A cuántos kilogramos equivale una libramasa?
|
0.45359237 Kg
|
|
¿A cuántos metros equivale un pie?
|
0.3048 m
|
|
¿A cuántos gramos mol equivale una libramol?
|
453.59237 gmol
|
|
¿Qué leyes rigen la manipulación de unidades dimensionales?
|
1, La suma o resta solo se efectúa entre cantidades con mismas unidades, de lo contrario no tiene sentido.
2, La multiplicación o división de cantidades con distintas unidades produce un producto con unidades de dichas cantidades. 3, La división de cantidades de mismas unidades produce cantidades adimensionales. 4, El producto de cantidades con mismas unidades da un resultado cuyo unidad se eleva a una potencia correspondiente. |
|
¿Qué es la Conversión de Unidades?
|
Es el proceso mediante el cual se aplican las definiciones de unidades en forma sucesiva para transformar una cantidad expresada de un conjunto de unidades a la cantidad equivalente en otro conjunto de unidades.
|
|
¿Cuáles son los 5 tipos de composiciones en el balance de materia?
|
1, Concentración molar, moles de un componente por volumen de solución.
2, Concentración másica, masa de un componente por volumen de solución. 3, Fracción mol, moles de un componente por mol de mezcla. 4, Fracción masa, masa de un componente por unidad de masa de mezcla. 5, Fracción mol/masa libres de solvente, moles o masa de una sustancia por mol de mezcla sin tomar en cuenta el solvente. |
|
¿En qué y único caso se aplica el principio de conservación de la materia a las sustancias?
|
Solo cuando es un sistema sin reacción.
|
|
¿Qué se necesita para efectuar las conversiones entre las medidas de composición?
|
Densidad, Volumen especifico o molar y peso molecular promedio.
|
|
¿Cómo se relaciona la densidad y el volumen especifico?
|
Son reciprocos entre si.
|
|
¿Qué es el peso molecular promedio?
|
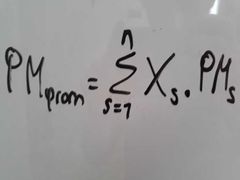
Es la suma de los productos de las fracciones mol multiplicadas por el peso molecular de cada uno de los componentes de la mezcla.
|