- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
27 Cartas en este set
- Frente
- Atrás
|
Química orgánica
|
El estudio de los compuestos del carbono. (N,P,O,S,Cl, etc.)
|
|
Función de onda
|
Describe el espacio donde es más probable encontrar a un electrón.
|
|
Historia de la química orgánica
|
-Siglo XVIII Alquimistas
-Diferencia entre comp. de organismos vivos y de los minerales. -Comp. origen animal difíciles de aislar y purificar, pues se degradaban. -1770 Torbern Bergman: "química de los compuestos vivientes". |
|
Historia de la química orgánica 2
|
-La diferencia: la Fuerza Vital
-1816 Michael Chevreul: grasa animal +NaOH > jabón+glicerina -1828 Frederic Wohler: Urea a partir de cianato de amonio. -XIX Confusión para delimitar ambas químicas -1850 Contienen carbono |
|
Z
|
Número atómico, representa el número de protones. Coincide con el número de electrones.
|
|
A
|
Número de masa. Es la suma de protones más neutrones.
|
|
Isótopo
|

Formas atómicas de una mismo elemento que difiere en su número de neutrones.
|
|
Orbitales
|
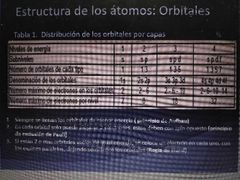
|
|
Energía de ionización
|
Cantidad de energía necesaria para extraer un electrón.
|
|
Afinidad electrónica
|
Cantidad de energía liberada al aceptar un electrón
|
|
Energía de disociación de enlace
|
Energía que se requiere para romper un enlace.
|
|
Longitud de enlace
|
Distancia óptima a la cual dos núcleos pueden acercarse y formar un enlace.
|
|
Enlace sigma
|
Formación de enlace por traslape frontal de orbitales p en el mismo eje. Máxima superposición.
|
|
Enlace pi
|
Formación de enlace por traslape de orbitales p en ejes paralelos.
|
|
Enlace iónico
|
Unión de átomos debido a la atracción electrostática entre los iones de distinto signo.
|
|
Enlace covalente
|
Se forma por la superposición de orbitales atómicos. Se comparten electrones.
|
|
Características del enlace iónico
|
-Enlace fuerte
-Sólidos de estructura cristalina -Altos puntos de fusión y ebullición -Metales I y II y no metales VI y VII -Solubles en agua y conducen la electricidad |
|
Fuerzas de Van ser Waals
|
Entre moléculas no polares que presentan momentáneamente cargas parciales.
|
|
Puentes de hidrógeno
|
Un átomo de hidrógeno unido a un átomo muy electronegativo con pared de electrones libres.
|
|
Hibridación del carbono
|
El carbono se hibridiza en la configuración más estable de 4 electrones desapareados.
|
|
Hibridación sp3
|
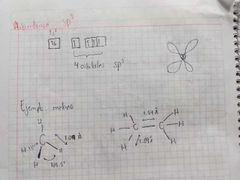
|
|
Hibridación sp2
|
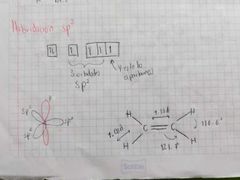
|
|
Hibridación sp
|

|
|
Isómeros constitucionales
|
Compuestos de igual fórmula pero diferente estructura.
|
|
Isómeros constitucionales: carbono-carbono
|

|
|
Isómeros constitucionales: grupo funcional
|

|
|
Isómeros constitucionales: posición de grupo funcional
|

|