- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
86 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
Descubrió el átomo
|
Demócrito descubrió el átomo
|
|
|
Descubrió que si se combinan átomos forman compuestos
|
Dalton
|
|
|
"Los compuestos y las mezclas son diferentes"
|
Boyle
|
|
|
Clasificó los elementos
|
Mendeliev
|
|
|
Descubre el electrón y su modelo atómico fue el de "panqué de pasas"
|
Thomson
|
|
|
Propuso un núcleo con protones y electrones que giran alrededor . El núcleo posee la masa del átomo.
|
Rutherford
|
|
|
Los electrones giran a gran velocidad en orbitales con diferentes niveles de energía
|
Borh
|
|
|
Descubrió el neutrón
|
James Chadwick
|
|
|
"... los orbitales tienen diferentes figuras geométricas"
|
Schrödinger Y Heisenberg
|
|
|
¿Qué determina el peso del átomo?
|
Los protones y neutrones
|
|
|
Catión
|
Ión con carga positiva que pierde electrones
|
|
|
Anión
|
Ión que tiene carga negativa y gana electrones
|
|
|
Isótopos
|
Átomos de un mismo elemento que difiere con la cantidad de neutrones , por lo tanto tienen diferente masa atómica.
|
|
|
Electronegatividad
|
Capacidad de atracción de electrones para formar enlaces.
aumenta de izquierda a derecha y de abajo a arriba |
|
|
Radio Atómico - Actividad Química metálica
|
Capacidad de perder electrones
Aumenta de arriba- abajo y derecha a izquierda |
|
|
Número de oxidación
|
Nos dice si un elemento gana o pierde electrones
|
|
|
Números de oxidación de Cu
|
+1 +2
|
|
|
Números de oxidación de Au
|
+1 +3
|
|
|
Números de oxidación de Fe
|
+2 +3
|
|
|
Números de oxidación de Co
|
+2 +3
|
|
|
Configuración electrónica
|
Sirve para saber cómo acomodar los electrones que giran alrededor del núcleo.
|
|
|
¿Cuáles son los 4 niveles de energía?
|
(sopita de fideos)
S² P⁶ d¹⁰ F¹⁴ |
|
|
Números cuánticos
|
(Ni Me Lo Se)
n - nivel l - subnivel/asimutal (forma geométrica) (s-0, p-1, d-2, f-3) m - orientación/orientación magnética del electrón (s- un Uber, p - 3 ubers, d- 5 ubers , f- 7 ubers) s - spin (↑ +½ , ↓ -½) |
ejercicio
|
|
Principio de Heisenberg
|
Existen un límite en la presición en el cual podemos determinar la posición del electrón en un tiempo determinado
|
|
|
Enlace Iónico
|
-Metal + No metal
- Mayor a 1.7 - Tranferencia de electrones - Sales |
|
|
Enlace Metálico
|
- Metal + Metal
- Mar de electrones |
|
|
Covalente
|
No metal + No metal
-Comparten electrones - Solubles en compuestos apolares |
|
|
Covalente polar
|
- Gas + Hidrógeno
- 0.4→ 1.7 |
|
|
Covalente Apolar o no polar
|
Unión de Gases diferentes o uno igual pero repetido
- Menor a 0.4 |
|
|
Enlace coordinado
|
Solo uno de ellos da un par de electrones
|
|
|
Nomenclatura STOK - IUPAC
|
Toma en cuenta los números de oxidación
- Na2 O = Óxido de sodio (I) (Números de oxidación: Na - 1 , O - –2) |
|
|
Nomenclatura Sistemática
|
Toma en cuenta el número de átomos del compuesto , usa sufijos como: mono , di , Tri ,tetra.
Na2 O → Monóxido de Sodio |
|
|
Óxidos Básicos
|
Metal + Oxígeno
|
|
|
Óxidos ácidos
|
No metal + Oxígeno
|
|
|
Bases
|
Metal + OH
|
|
|
Hidruro
|
Metal + Hidrógeno
|
|
|
A+B→AB
|
Síntesis o combinación
|
|
|
AB→ A+B
|
Analizar o descomposición
|
|
|
AB+C→ CB+A
|
Sustitución simple (Chapulín)
|
|
|
AB+CB → CB + AD
|
Doble sustitución (las más largas)
|
|
|
Masa molecular
|
Masa total de todos los átomos que componen un compuesto químico
|
|
|
Masa molecular
|
Masa total de todos los átomos que componen un compuesto químico
|
|
|
Número de Avogadro
|
6.023×10²³ = 1 Mol = 22.4 litros
|
|
|
Ecuación de Molaridad
|
M= masa(g) / Masa molecular×Volumen(lt)
|
|
|
Ecuación de Molalidad
|
m= masa(g) / masa molecular × masa del solvente (kg)
|
|
|
Suspención
|
Mezcla heterogénea dónde se separan sus componentes
|
|
|
Método de separación de mezclas que se usa para obtener los componentes de una disolución
|
Destilación y cristalización
|
|
|
Ecuación de Normalidad
|
N = masa(g) / Peso equivalente × Volumen (lt)
|
|
|
Peso equivalente
|
- Ácidos→ Peso Molecular/ n° de H+
- Bases → Peso molecular/ n° de OH - Sales→ Peso molecular / subíndice del primer elemento. |
|
|
Ecuación % M
|
%m = masa del soluto / masa de la solución (soluto+disolvente)
|
|
|
Ecuación % V
|
%v = volumen del soluto/ volumen de la disolución ( soluto + disolvente)
|
|
|
Ácidos
|
-H+
-PH menor a 7 |
|
|
Bases
|
- OH
- PH mayor a 7 |
|
|
Arrenius (el chido)
|
- Ácidos → Liberan H+
- Bases → Liberan OH+ |
|
|
Bronsted Lowry (Habla de protones)
|
- Ácidos → pierden protones
- Bases → ganan protones |
|
|
Ley de Charles (No tiene pelo) (Presión constante)
|
V/t = V/t
|
|
|
Ley de Gay Lussac (verdura) (volumen constante)
|
P/t = P/t
|
|
|
Tipos de Carbonos
|
→Carbono primario - CH3
→Carbono secundario - CH2 →Carbono terciario - CH →Carbono cuaternario - C |
|
|
ano (enlace simple)
|
- Sp³
- Ángulo de 109.5 - Forma tetraedrica |
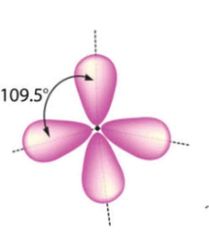
|
|
Eno (enlace doble)
|
- Sp2
- Ángulo 120 - Forma triangular |
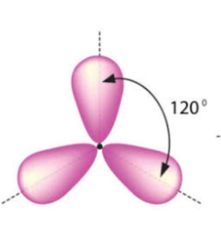
|
|
Ino (Enlace triple)
|
- Sp
- Ángulo 180 - Forma lineal |
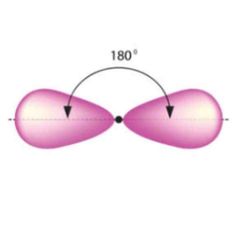
|
|
Alcohol
|
|
|
|
Aldehído
|
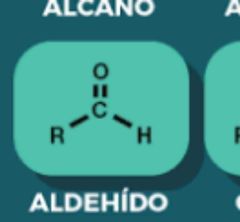
|
|
|
Cetona
|
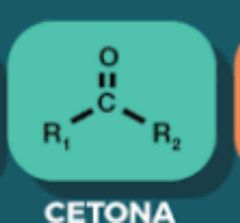
|
|
|
Ácido Carboxilico
|
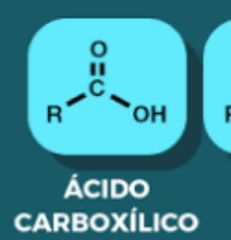
|
|
|
Eter
|
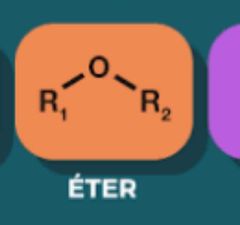
|
|
|
Ester
|
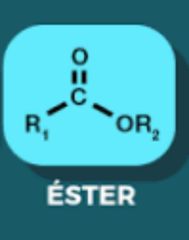
|
|
|
Amina
|
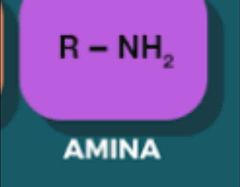
|
|
|
Amida
|
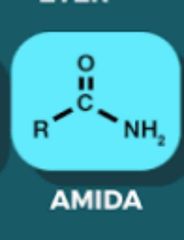
|
|
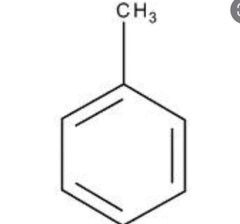
Tolueno
|
Tolueno
|
|
|
Localizaciones en compuestos aromáticos
|
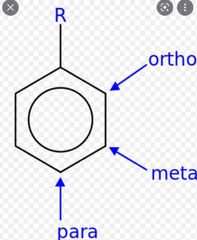
|
|
|
Lewis (habla de electrones)
|
- Ácidos → Ganan electrones
- Bases → Pierden electrones. |
|
|
Calor
|
Energía media de las moléculas
|
|
|
Temperatura
|
Energía cinética promedio de las moléculas
|
|
|
Permite entrada y salida de energía y materia
|
Sistema abierto
|
|
|
Solo ocurre transferencia de energía
|
Sistema cerrado
|
|
|
Solo ocurre transferencia de energía
|
Sistema cerrado
|
|
|
No permite ni entrada no salida de energía y materia
|
Sistema Aislado
|
|
|
Energía libre de GBbs (G)
|
Factibilidad de un proceso
|
|
|
Entalpía (H)
∆H= (Hproductos) - (Hreactivos) |
Energía transferida o absorbida a una presión constante
|
|
|
Entropía (S)
|
Media del desorden de un sistema
|
|
|
Ley combinada de los gases
(Boyle-Mariotte, Charles y Gay Lussac) |
PV / t (pancho Villa sobre tu tía)
|
|
|
Ley de Boyle (Temperatura constante)
|
PV=PV
|
|
|
Sales binarias
|
Metal + No metal
|
|
|
Oxisales
|
Metal + No metal + O
|
|
|
Oxiácidos
|
H + No metal + O
|