- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
22 Cartas en este set
- Frente
- Atrás
|
Ley de Proust o...
|
ley de proporciones definidas (si la constante de masa es igual, el compuesto es el mismo)
|
|
Ley de Dalton o...
|
ley de proporciones múltiples (una masa constante con otra variable con relación de números enteros)
|
|
Regla de máxima multiplicidad de Hund
|
los electrones en los orbitales de energía se acomodan semiocupando los orbitales
|
|
Geometría molecular
|
hibridación sp=alquino, triple enlace, lineal, 180°
hibridación sp^2=alqueno, doble enlace, triangular plana,120° hibridación sp^3=alcano, enlace simple, tetraédrica, 109.5° -piramidal trigonal, 107° |
|
Tipos de enlace (enlace valencia y modelos de hibridación)
|
enlace simple=sigma
enlace doble=sigma pi enlace triple=sigma pi pi |
|
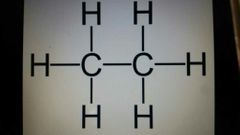
etano
C.2H.6 |
|
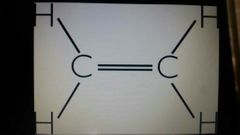
eteno (o etileno)
C.2H.4 |
|
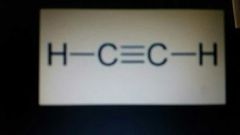
etino (o acetileno)
C.2H.2 |
|
Fuerzas intermoleculares
|
-Dipo-Dipolo (Van der Waals)=Polares, estables.
-Dipolo instantáneo/Dipolo inducido (Fuerzas de London)=Apolares, muy inestables. -Enlaces de hidrógeno(H+electronegativos: N, O, F)=Enlace por puente de Hidrógeno, muy fuerte. |
|
Conversión de unidades (Química)
|
Gramos->Moles->Moléculas->Átomos
peso molecular=g/mol 1mol=6.022•10^23 moléculas |
|
Pasos de estequiometría
|
1.-Calcular pesos molares.
2.-Balancear. 3.-Leer ejercicio y colocar datos. 4.-Pasar gramos a moles. (para poder relacionar tiene que estar todo en moles) 5.-Localizar el reactivo limitante.(el limitante está en menor cantidad que el exceso) (relacionando los moles de los reactivos en proporción) 6.-Calcular el resto de datos. (a partir del limitante) 7.-Calcular exceso. (a partir del limitante) |
|
Entalpía
|
Calor liberado o absorbido a presión constante:
Exotérmica=libera calor (-) Endotérmica=absorbe calor (+) |
|
Entropía
|
Grado de desorden en un sistema
/\S<0 Aumenta el orden /\S>0 Aumenta el desorden |
|
Entalpía de reacción
|
Energía de enlace.
/\Hr=E(energía de enlace rotos)-E(energía de enlaces formados E es sumatoria |
|
Masa atómica y número atómico
|
A=Número de protones+neutrones
Z=Número de protones A>Z |
|
Números de Oxidación
|
1.-Estado fundamental=0
2.-Alcalinos=+1 3.-Alcalinotérreos=+2 4.-H+Metal= H->-1 5.-H+No metal=H->+1 6.-Oxido=-2 Peróxido=-1 7.-Oxiácidos=H->+ O->-2 8.-Oxisales=se calcula con un ácido, despues, sin hidrógeno |
|
N.A (Número de Avogadro)
|
6.022•10^23
|
|
Energía libre de Gibbs (espontaneidad)
|
/\G=/\H-T/\S
/\G<0 -> Espontánea /\G>0 -> No espontánea /\S es Entropía |
|
Combustión
|
Un reactivo que reacciona con O.2 produce CO.2 +H.2O+ energía y luz
|
|
Entalpía por Ley de Hess
|
La reacción es proporcional a la entalpía, se puede tratar a las reacciones como un sistema de ecuaciones cuando la suma de los productos de dos reactivos es similar al producto de un tercer reactivo.
|
|
Mol
|
Cantidad de sustancia que contiene tantas entidades elementales (iones, átomos, moléculas) como átomos hay en 12 gr del isótopo Carbono 12.
|
|
Constante de los gases
|
R=0.082 aproximadamente
|