- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
133 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
la ciencia que estudia la composición, estructura, propiedades y transformación de la materia:
|
Química
|
|
|
La división de la química especial es:
|
Inorgánica, Organica, Analitica, Bioquimica
|
|
|
la división de la química es:
|
General, especial, aplicada
|
|
|
La rama de la química que estudia las leyes principios, teorías y todo lo relacionado a la materia
|
Quimica General
|
|
|
La quimica aplicada estudia:
|
Geoquimica, Petroquimica, Mineralogía
|
|
|
Quimica Analitica:
|
Cuantitativa: Determina la cantidad de sustancia.
Cualitativa: Identifica cantidades de una sustancia. |
|
|
La sustancia fundamental de las cuales está compuesta la materia es:
|
Elementos
|
|
|
Las sustancias puras constituidas por elementos de dos o más tipos combinados en proporción fija se conocen como:
|
Compuestos
|
|
|
Las moléculas y compuestos derivados del Carbono y sus combinaciones químicas son estudiadas por:
|
Química Orgánica
|
|
|
Las moléculas más simples que se organizan para constituirse en materia y las combinaciones químicas sencillas son estudiadas por:
|
Química Inorgánica
|
|
|
Todo lo que posee masa inercia y ocupa un lugar en el espacio se conoce como:
|
Materia
|
|
|
Las propiedad característica que relacionan los cambios de composición de una sustancia o sus reacciones con otras sustancias se llaman:
|
Propiedad química
|
|
|
Las moléculas más simples que se organizan para constituirse en materia y las combinaciones químicas sencillas son estudiadas por:
|
Química Inorgánica
|
|
|
La propiedad de la materia que corresponde a la capacidad de un metal de ser estirado y convertido en alambre se conoce como.
|
Ductilidad
|
|
|
Ayuda con la síntesis de diferentes fármacos antibióticos analgésicos, antidepresivos, vitaminas radios topos:
|
Importancia
|
Clasifique las siguientes aseveraciones como ventajas o desventajas o Importancia de la química:
|
|
Permite sintetizar sustancias llamadas saborizantes y colorantes para ciertas propiedades de los alimentos y así no se deterioran:
|
Importancia
|
Clasifique las siguientes aseveraciones como ventajas o desventajas o Importancia de la química:
|
|
La química puede disminuir los problemas del medio ambiente y ayudar al humano a mejorar su estilo de vida:
|
Ventaja
|
Clasifique las siguientes aseveraciones como ventajas o desventajas o Importancia de la química:
|
|
La química perjudica tanto el medio ambiente; tanto que ese deño no se le encuentra solución:
|
Desventaja
|
Clasifique las siguientes aseveraciones como ventajas o desventajas o Importancia de la química:
|
|
Una de las propiedades generales de la materia es la siguiente.
|
Volumen
|
|
|
Las características que identifican a una sustancia sin alterar su composición es conocida como:
|
Propiedad física
|
|
|
La cantidad de materia que posee un cuerpo se denomina como:
|
Masa
|
|
|
Son aquellas propiedades que se manifiestan al alterar su estructura interna o molecular, cuando interactúan con otras sustancias:
|
Propiedad Quimica
|
|
|
define las propiedades de la materia correctamente:
|
Son aquellas que describen las características particulares de una sustancia
|
|
|
Las características que identifican a una sustancia sin alterar su composición es conocida como:
|
Propiedad fisica
|
|
|
presenta correctamente ejemplo de propiedades químicas:
|
El Fe se oxida a temperatura ambiental
|
|
|
El elemento indispensable para que las cosas se quemen o ardan con el Oxigeno recibe el nombre de:
|
Comburente
|
|
|
El fenómeno de cambio de estado de agua liquida a solida se denomina:
|
Solidificación
|
|
|
El fenómeno de cambio de estado de agua solida a gaseosa se denomina:
|
Sublimación
|
|
|
¿Qué Se considera un fenómeno Químico?
|
Cambio en la estructura interna de la materia
|
|
|
¿Qué se considera fenómeno Físico?
|
Cambio en el estado de agregación de la materia sin cambiar su estructura interna
|
|
|
Son aquellas propiedades que se manifiestan al alterar su estructura interna o molecular, cuando interactúan con otras sustancias:
|
Propiedad quimica
|
|
|
El fenómeno que se produce al quemarse un combustible se llama:
|
Combustión
|
|
|
El fenómeno de cambio de estado de agua gaseosa a solida se denomina:
|
Sublimación regresiva
|
|
|
La magnitud física derivada, que se define como: el espacio que ocupa un cuerpo en el universo, las unidades para medirlo son el metro cubico, centímetro cubico, litro, mililitro.
|
Volumen
|
|
|
Propiedades extensivas llamadas también generales, como su nombre lo indica, están basadas en la función siguiente:
|
Cantidad de materia
|
|
|
La unidad de masa en el sistema internacional de unidades es:
|
El kilogramo
|
|
|
La relación existente entre la fuerza de atracción que ejerce la tierra sobre una determinada cantidad de masa se conoce como:
|
Peso
|
|
|
Una propiedad extensiva importando el tamaño, en el sentido de que si se divide el sistema en dos o más partes y estas se suman se conoce como:
|
Propiedad aditiva
|
|
|
Propiedad intensiva que se refiere a la temperatura en la cual el estado sólido y líquido de una sustancia coexisten en el equilibrio térmico:
|
Punto de fusión
|
|
|
Propiedades extensivas llamadas también generales, como su nombre lo indica, están basadas en la función siguiente:
|
Cantidad de materia
|
|
|
La relación existente entre la cantidad de materia que posee un cuerpo y el espacio que esta ocupa se define como:
|
Densidad
|
|
|
La temperatura en donde la presión de vapor del líquido es igual a la presión del medio que rodea al líquido se conoce como:
|
Punto de ebullición
|
|
|
Las propiedades intensivas no dependen de la cantidad de materia, por lo tanto una de estas es la siguiente:
|
Viscosidad
|
|
|
Las características de la materia que son independientes de la cantidad a medir, no importa la cantidad pues estas propiedades siempre permanecen constantes, no son aditivas, en muchos casos son el resultado de dos propiedades extensivas
|
Propiedades intensivas
|
|
|
La unidad de masa en el sistema internacional de unidades es:
|
Kilogramo
|
|
|
Que científico descubrió el electrón, y determinó que la materia se componía de dos partes, una negativa y una positiva:
|
Joseph John Thomson
|
|
|
¿Qué Se considera un fenómeno Químico?
|
Cambio en la estructura interna de la materia
|
|
|
Qué científico propone un modelo de atomo que describe a los electrones como una función de onda.
|
Erwin Schrödinger
|
|
|
La teoría atómica se ha ido explicando de tal manera que siga una secuencia lógica, esta se logra a través de :
|
Atravez de una reseña histórica
|
|
|
Que científico postulo la siguiente afirmación referente a los componentes del atomo: la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas.
|
Ernest Rutherford
|
|
|
El Literal que presenta correctamente la definición de la química inorgánica es:
|
Estudia los elementos de la tabla periódica
|
|
|
El primer modelo atómico con bases científicas, fue formulado por:
|
John Dalton
|
|
|
Para el orbital s aumenta su tamaño de acuerdo a lo siguiente:
|
Aumenta al aumentar el nivel de energía
|
|
|
El conjunto de números cuánticos más ampliamente estudiado en Química corresponde al siguiente numero de electrones:
|
A un solo electrón
|
|
|
El Número cuántico del momento angular ó azimutal ó secundario está representado por la letra:
|
l
|
|
|
Cuantos orbitales contienen el subnivel d, para cualquier número cuántico principal:
|
5
|
|
|
Los posibles valores para el numero cuantico principal (n), son los siguientes:
|
0, 1, 2, 3…..n
|
|
|
Los símbolos que representan a los números cuanticos son los siguientes:
|
n, l, m, s
|
|
|
Las propiedades periódicas de los elementos son función periódica de sus números atómicos, esta ley fue dada por:
|
Moseley
|
|
|
El literal que define correctamente un periodo es:
|
Son las filas horizontales e indican el nivel de energía principal
|
|
|
El literal que presenta correctamente un elemento del bloque s, d, p es.
|
Mg, Co, Ge
|
|
|
El literal que presenta al químico que clasifico los elementos en octavas es:
|
Jhon Newlands
|
|
|
Entre las propiedades de los metales podemos mencionar:
|
-Tienen bajos y altos puntos de fusión
-Son electropositivos(es decir forman iones positivos) -Son sólidos (excepto el mercurio que es líquido) |
|
|
El literal que presenta correctamente un gas noble, un elemento representativo y uno de transición es:
|
Ar, Fe, P
|
|
|
Seleccione el literal que presenta un no metal, un semimetal y un metal es:
|
Cl, Al, Mn
|
|
|
El literal que contiene un halógeno, un gas noble y un actínido es:
|
I, Xe, Pu
|
|
|
El literal que presenta la definición correcta de las propiedades periódicas es:
|
Las propiedades de los elementos son función periódicas de su número atómico.
|
|
|
El literal que presenta la afirmación correcta del radio atónico es:
|
A lo largo de un periodo el tamaño del átomo disminuye de izquierda a derecha y de arriba hacia abajo en un grupo aumenta.
|
|
|
El elemento con menor electronegatividad se encuentra en el literal:
|
Cs
|
La electronegatividad aumenta cuando nos trasladamos en un periodo de izquierda a derecha y aumenta en un grupo de abajo hacia arriba
|
|
La afirmación correcta sobre la energía de ionización se encuentra en el literal:
|
Los elementos del periodo dos tienen mayor energía de ionización que los elementos del periodo cuatro y en un grupo crece de abajo hacia arriba.
|
|
|
El elemento con mayor afinidad electrónica se encuentra en el literal:
|
Ne
|
La afinidad electronica incrementa al ir en un período de izquierda a derecha y aumenta de abajo hacia arriba en un grupo.
|
|
Seleccione el literal que presenta correctamente el tamaño del volumen iónico de las siguientes especies químicas:
|
Mg > Mg2+ y O < O2-
|
Los iones negativos tienen radios más grandes que los correspondientes átomos neutros, por la ganancia de electrones
Los iones positivos, tienen radios más pequeños que los correspondientes átomos neutros, porque pierden electrones |
|
Antes de que la química se sistematizara, se asignaba un nombre a la sustancia, casi siempre relacionado con:
|
Propiedades físicas o químicas
|
|
|
En general en esta clase se verán los siguientes aspectos:
|
Nomenclatura inorgánica
|
|
|
Los químicos prefieren usar nombres sistemáticos, porque identifican con precisión la composición química de las sustancias. Por lo tanto decidieron un sistema de nomenclatura general llamado:
|
Nomenclatura IUPAC
|
|
|
La capacidad de combinación de un elemento con relación a otro se conoce como:
|
Valencia
|
|
|
Son compuestos formados por tres elementos:
|
Compuesto terciario
|
|
|
Usado para escribir correctamente formulas químicas de los compuestos:
|
Numero de oxidación
|
|
|
El acido sulfúrico (H2SO4), fue conocido originalmente como:
|
Aceite de vitriolo
|
|
|
Considerando el siguiente compuesto Cloruro de Magnesio (MgCl2), el número de oxidación de ambos es el siguiente:
|
2+ y 1-
|
Numero de oxidacion del magnesio es +2 Por el número de atomos de magesio 1 = 2
Número de oxidacion del Cloro es -1 Por el número de atomos de cloro 2 = -2 La suma de esto debe ser siempre cero |
|
En el siguiente compuesto OF2 el número de oxidación del Fluor (F) es el siguiente:
|
2+
|
El número de oxidacion del Fluor es +1 por el numero de atomos de Flour 2 = +2
|
|
El estado de oxidación está relacionado con lo siguiente:
|
Un número
|
|
|
El estado de oxidación de un átomo individual en un elemento libre (sin combinar con otros elementos) tiene un número de oxidación igual a:
|
0
|
El estado de oxidación de un átomo individual en un elemento libre (sin combinar con otros elementos) es cero
|
|
Las siguientes moléculas: Cl2, N2, O2, H2 tienen un número de oxidación igual a:
|
0
|
El número de oxidación es cero para sustancias elementales moleculares como: CL2, N2, O2, H2 y todos los halógenos (Grupo VII A o Grupo 17)
|
|
Considerando el siguiente compuesto Ácido Sulfúrico (H2SO4) el número de oxidación del Azufre es el siguiente:
|
6+
|
El numero de oxidacion del Hidrogeno es +1 por el numero de moleculas de Hidrogeno 2 = 2
El numero de oxidacion del Oxigeno es -2 por el numero de moleculas de Oxigeno = -8 la suma de todos los números de oxidación de un compuesto debe dar cero Por ecuacíon -8 +2 +x = 0 x = 8-2 X = 6 El numero de oxidacion del azufre es +6 |
|
Los Halógenos en compuestos binarios presenta un estado de oxidación de:
|
1-
|
|
|
Los elementos cargados que se utilizan para escribir una formula química tanto positiva como negativa, reciben el nombre de:
|
Catión y anión
|
|
|
Cuando en los compuestos binarios la valencia de los elementos es diferente, se intercambian los subíndices en forma:
|
En forma cruzada
|
|
|
El ion (NO2)- posee el nombre de:
|
Nitrito
|
|
|
El ion (OH)- posee el nombre de:
|
Hidróxido
|
|
|
¿Qué principio se utiliza para escribir correctamente una formula química?
|
Principio de electrovalencia
|
|
|
El Ion amonio está representado por la siguiente ion:
|
NH4+
|
|
|
El ion (SCN)- posee el nombre de:
|
Tiocianato
|
|
|
La valencia utilizada por el Cloro y el Hierro en el Cloruro de Hierro (III) FeCl3 es la siguiente:
|
1 y 3
|
Cuando la valencia de un numero es (1) no se escribe
|
|
El Ion sulfito está representado por la siguiente ion:
|
(SO3)2-
|
|
|
Los iones formados por dos o más átomos diferentes se conocen como:
|
Iones poliatómico
|
|
|
Los compuestos que se forman por combinación de oxido ácido con agua se nombran como:
|
Ácidos oxácidos
|
|
|
Aquellos compuestos que se forman entre el oxígeno y los metales se conocen como:
|
Oxidos metálicos
|
|
|
En el sistema STOCK el nombre del compuesto CO se escribe como:
|
Oxido de carbono(II)
|
|
|
Los compuestos que se forman cuando un óxido básico reacciona con el agua se conocen como:
|
Hidróxidos
|
|
|
Los compuestos binarios en el sistema clásico se nombran con el término final siguiente:
|
uro e ido
|
|
|
Los compuestos que tienen hidrógeno unido a un no metal corresponden a:
|
Ácidos hidrácidos
|
|
|
Para nombrar compuestos en el sistema de nomenclatura estequiométrico se utiliza lo siguiente:
|
Prefijos griegos
|
|
|
De la unión entre un ácido oxácido y un metal se obtiene el siguiente compuesto:
|
Oxisales
|
|
|
Cuando los compuestos se forman entre el oxígeno y un no metal se conocen como:
|
Anhídridos u óxidos ácidos
|
|
|
En el sistema estequiométrico el nombre de CO2 es el siguiente:
|
Dioxido de Carbono
|
|
|
El literal que presenta correctamente dos propiedades de los compuestos iónicos es:
|
Se disuelven fácilmente en disolventes polares como el agua, en soluciones acuosas y fundido son buenos conductores de la electricidad
|
|
|
El literal que presenta la aseveración correcta del enlace iónico es:
|
El enlace iónico se de por transferencia total de electrones
|
|
|
El literal que define correctamente el enlace químico es:
|
Son las fuerzas que mantienen unido a los átomos en un compuesto
|
|
|
El literal que presenta correctamente la definición de las estructuras de Lewis es.
|
Representan los electrones de valencia por medio de puntos
|
|
|
Seleccione el literal que presenta el enlace químico correctamente
|
Iónico, covalente, metálico
|
|
|
El literal que afirma lo correcto del enlace covalente coordinado es:
|
Se da cuando un átomo no metálico comparte al menos un par de electrones.
|
|
|
El literal que presenta un compuesto que puede formar enlace covalente coordinado es:
|
NaOH
|
|
|
De los compuestos covalentes podemos afirmar “ECEPTO”:
|
Son buenos conductores del calor y la electricidad
|
|
|
El literal que presenta la aseveración correcta a cerca del enlace covalente polar
|
Se da entre dos no metales diferentes
|
|
|
El literal que presenta solo compuestos covalentes puros es:
|
HI, N2, Cl2
|
|
|
El literal que presenta la afirmación correcta sobre el enlace múltiple es:
|
Hay enlaces dobles y triples
|
|
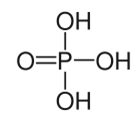
El literal que presenta correctamente la cantidad de enlaces sigma (σ) y pi (π) del siguiente compuesto es:
|
7 σ, 1 π
|
Un enlace simple es: un enlace sigma. Un enlace doble es: un enlace sigma y un pi. Un enlace triple es: un enlaces sigma y dos enlaces pi.
Ojo: en la imagen se observa el Oxigeno e Hidrogeno juntos pero entre ellos existe un enlace simple. |
|
Seleccione el literal que presenta una característica del enlace metálico:
|
Se da entre átomos metálicos
|
|
|
Seleccione el literal que presenta una propiedad de los compuestos metálicos:
|
Tienen puntos de fusión y ebullición muy variados (aunque suelen ser más bien alto).
|
|
|
La siguiente ecuación química C4H10 + O2 ------------> H2O + CO2 balanceada presenta:
|
2mol C4H10 , 13 molO2, 10mol H2O, 8mol CO2
|
|
|
El literal que presenta el elemento de mayor carácter metálico es:
|
Cs
|
|
|
El literal que identifica una reacción de síntesis es:
|
2H2 + O2 --------------> 2H2O
|
|
|
Los reactantes en una ecuación química se encuentran:
|
A la izquierda de la ecuación química
|
|
|
Al proceso en el cual una sustancia o (sustancias) cambia para formar una o mas sustancias nuevas se le conoce como:
|
Reacción química
|
|
|
Cuando en una reacción química los productos son Bióxido de Carbono y Agua estamos en presencia de lo siguiente:
|
Reacción de combustión
|
|
|
A la representación de una reacción química se le puede denominar de la manera siguiente:
|
Ecuación química
|
|
|
En una ecuación química los componentes de esta se escriben de la siguiente manera:
|
Reactivos y productos
|
|
|
¿Cuál de las siguientes ecuaciones representa una reacción de neutralización?
|
KOH + HNO3 → KNO3 +H2O
|
maybe
|
|
Cuando dos o más elementos o compuestos se combinan, resultando en un solo producto,se conoce como una reacción química del tipo siguiente:
|
Reacción de síntesis
|
|
|
Cuando se forman dos o más productos a partir de un solo reactante ,se conoce como una reacción química del tipo siguiente:
|
Reacción de descomposición
|
|
|
¿Cuál de las siguientes ecuaciones representa una reacción de descomposición?
|
Ca(OH)2 → H2O + CaO
|
son aquellas en la cuales se forman dos o más productos a partir de un solo reactante, usualmente con la ayuda del calor o la electricidad.
|
|
¿Cuál de las siguientes ecuaciones representa una reacción de desplazamiento?
|
KOH + HNO3 → KNO3 +H2O
Ca(OH)2 → H2O + CaO K2SO4 + 2 NaOH → Na2SO2 + 2KOH |
* Probada y fallada
2 K + 2 HCl → 2 KCl +H2 * |