- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
61 Cartas en este set
- Frente
- Atrás
|
CAPAS DE LA ATMÓSFERA
|
...
|
|
Aire
|
Mezcla homogénea de gases
|
|
La atmósfera se mantiene alrededor de la Tierra debido a..
|
La fuerza de atracción de la gravedad
|
|
Capa de ozono esta dentro de..
|
La estratosfera
|
|
Exosfera+termosfera=
|
Ionosfera
|
|
Auroras boreales
|
El color se hace por el salto de electrones en diferentes niveles de energía
|
|
Evolución de la atmósfera
|
Solo había hidrógeno y helio
Gases anteriores hacen que la vida surga(oxigeno y fotosíntesis ) Final= capa de ozono |
|
Exosfera+termosfera=
|
Ionosfera
|
|
Auroras boreales
|
El color se hace por el salto de electrones en diferentes niveles de energía
|
|
Evolución de la atmósfera
|
Solo había hidrógeno y helio
Gases anteriores hacen que la vida surga(oxigeno y fotosíntesis ) Final= capa de ozono |
|
Gas más abundante del aire
|
Nitrógeno pero es gas inherente y no se toma en cuenta
|
|
Otros gases en el aire
|
Oxigeno 20.95%
Nitrógeno 78.08% CO2 0.035% Argón 0.93% |
|
Otros gases en el aire
|
Oxigeno 20.95%
Nitrógeno 78.08% CO2 0.035% Argón 0.93% |
|
Teoria cinética molecular
|
...
|
|
Otros gases en el aire
|
Oxigeno 20.95%
Nitrógeno 78.08% CO2 0.035% Argón 0.93% |
|
TEORIA CINETICA MOLECULAR
|
...
|
|
Las partículas de un gas...
|
No se atraen ni se repelen entre si. Son muchos más pequeñas que la distancia entre ellas, están en movimiento constante, choques elasticos( no se pierde energía ) A mayor temperatura, mayor energía cinetica
|
|
Ley de charles
|
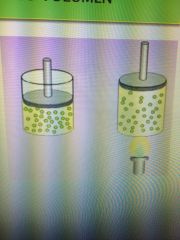
A presión constante, la temperatura de un gas es directamente proporcional a su volumen
|
|
Ley de boyle
|
A temperatura constante, el volumen de un gas es inversamente proporcional a la presión aplicada
|
|
Ley de boyle
|
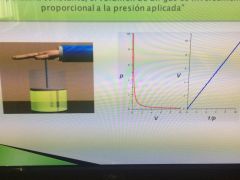
A temperatura constante, el volumen de un gas es inversamente proporcional a la presión aplicada
|
|
Ley de Gay-lussac
|

A volumen constante, la presión ejercida por un gas es directamente proporcional a la temperatura aplicada
|
|
MOL
|
Masa atómica (para elementos) o masa molecular (para compuestos) expresada en gramos
|
|
MOL
|
Masa atómica (para elementos) o masa molecular (para compuestos) expresada en gramos
|
|
Cantidad de materia que contiene...
|
6.02x10 a la 23 partículas
|
|
Ley de avogadro
|
Volúmenes iguales de gases diferentes, a las mismas condiciones de presión y temperatura contienen el mismo número de moléculas
|
|
Ley de avogadro
|
Volúmenes iguales de gases diferentes, a las mismas condiciones de presión y temperatura contienen el mismo número de moléculas
|
|
Ley de avogadro #2
|
En condiciones normales (TPN), un lol de cualquier gas ocupa un volumen de 22.4 litros
|
|
Ley de avogadro
|
Volúmenes iguales de gases diferentes, a las mismas condiciones de presión y temperatura contienen el mismo número de moléculas
|
|
Ley de avogadro #2
|
En condiciones normales (TPN), un lol de cualquier gas ocupa un volumen de 22.4 litros
|
|
Condiciones normales
|
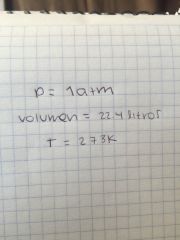
|
|
Ley del gas ideal
|
La presión es directamente proporcional a la temperatura e inversamente proporcional al volumen
|
|
NUMEROS CUÁNTICOS
|
Surgen de la resolución de la "ecuación de onda" propuesta en 1926 por Erwin Schrödinger
|
|
Numeros cuánticos #2
|
Describen el comportamiento y la energía de las partículas subatómicas. Se introduce el concepto de "Probabilidad" de la posición de los electrones
|
|
Números cuánticos #3
|
Los electrones son tratados como ondas y no existen órbitas, sino Orbitales
|
|
Numero cuántico principal
|
"n" indica el nivel de energía en el que se encuentra el electrón
|
|
Valores de n
|
1,2,3,4,5,6,7
|
|
Numero cuántico secundario o azitumal
|
"l" indica el subnivel de energía y la forma de los orbitales
Valores - 0,1,2...n-1 |
|
Numero cuántico secundario o azitumal
|
"l" indica el subnivel de energía y la forma de los orbitales
Valores - 0,1,2...n-1 |
|
A "l" se le designa con una letra ...
|
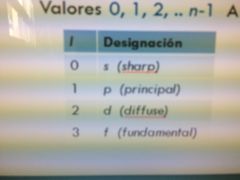
|
|
Numeros cuanricos
|

|
|
Numero cuántico magnetico
|
"m" indica la orientación de los orbitales en el espacio y el número de ellos
Valores: -1....0...+1 |
|
Numero cuántico magnetico
|
"m" indica la orientación de los orbitales en el espacio y el número de ellos
Valores: -1....0...+1 |
|
Orbital
|
Zona de máxima probabilidad en el espacio de encontrar un electrón
Le caben como máximo 2 electrones |
|
"m"
|

|
|
Spin (s)
|
Número cuántico que indica el sentido del giro del electrón
|
|
Configuraciones electrónicas
|
Indica la posición de cada uno de los electrones de un átomo en qué nivel subnivel y orbital se encuentra
|
|
Principio de Hund
|
En orbitales de la misma energía los electrones entran de a uno en cada orbital con el mismo spin
Cuando se alcanzarse mi llenado, comienza la apareamiento con espines opuestos |
|
Principio de Hund
|
En orbitales de la misma energía los electrones entran de a uno en cada orbital con el mismo spin
Cuando se alcanzarse mi llenado, comienza la apareamiento con espines opuestos |
|
Principios de Pauli
|
Dos electrones en la corteza de un átomo no pueden tener los cuatro números cuánticos iguales
|
|
Desarrollo de una configuración electronixa
|

|
|
Uso del kernel
|
Muestra entre corchetes, el símbolo de número atómico de gas noble anterior al elemento que se quiere representar
|
|
Configuración de iones
|
...
|
|
Configuración de iones
|
...
|
|
Aniones
|
Se agregan los electrones indicados por la carga, siempre En orbital "P"
Todos los aniones adquieren configuración de gas noble |
|
Cationes (+)
|
Se quitan los electrones indicados por la carga. Se quitan primero los electrones del nivel de energía más alto. Dentro del mismo nivel, se piden primero los electrones "P" y luego los "S"
|
|
Cationes (+)
|
Se quitan los electrones indicados por la carga. Se quitan primero los electrones del nivel de energía más alto. Dentro del mismo nivel, se piden primero los electrones "P" y luego los "S"
|
|
Excepciones
|
Los átomos de elementos de transición son más estables si su configuración electrónica terminan en d5 o d10
|
|
Cationes (+)
|
Se quitan los electrones indicados por la carga. Se quitan primero los electrones del nivel de energía más alto. Dentro del mismo nivel, se piden primero los electrones "P" y luego los "S"
|
|
Excepciones
|
Los átomos de elementos de transición son más estables si su configuración electrónica terminan en d5 o d10
|
|
Excepción #2
|
Los elementos que terminan en d4 pasan un electrón de "s" a "d" para terminar en d5
|
|
Excepcion
|
Los elementos que terminan en D9 hacen un electrón de "S"a "D" para terminar en d10 tal es el caso del cobre, plata y oro
|