- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
31 Cartas en este set
- Frente
- Atrás
|
¿Que es una pila?
|
Es un generador portátil de energía eléctrica, la cual se obtiene a partir de la transformación de energía química. Una pila no pierde la carga eléctrica salvo por la degradación física de sus componentes y este proceso es irreversible.
|
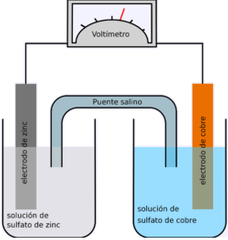
Celda electroquímica
|
Conformada por un ánodo que cede electrones, un cátodo atrae electrones, un electrolito conductor y un puente salino que brinda equilibrio químico a la reacción.
|
|
¿Que es una batería?
|
Una batería es un dispositivo con dos o más celdas electroquímicas que pueden convertir la energía química almacenada en corriente eléctrica, pero perderá energía con el paso del tiempo si no se recarga.
|
|
¿Qué es el amperaje (A)?
|
Es la cantidad de electrones que circula en un conductor por unidad de tiempo
|
|
¿Qué es el voltaje (V)?
|
Es la diferencia entre la carga o polo negativo y el positivo de un conductor, denominada diferencia de potencial y es la que determina el paso de la corriente eléctrica,
|
|
¿Qué es el ánodo?
|
Ánodo o electrodo negativo: aquí es donde alguna sustancia se desprende de electrones. A estas reacciones de pérdida de electrones las denominamos reacciones de oxidación.
|
|
¿Qué es el cátodo?
|
Cátodo o electrodo positivo: Aquí es donde alguna sustancia acepta los electrones. A estas reacciones de captura de electrones las denominamos reacciones de reducción. Es la reacción inversa a la oxidación.
|
|
¿Qué es el electrolito?
|
Un electrolito es cualquier sustancia que
contiene en su composición iones libres, que hacen que se comporte como un conductor eléctrico. |
|
Cómo funciona una batería
|
Se basa en una reacción electro-química Redox. Los dos polos están sumergidos en una solución electrolítica. El ánodo o polo negativo reacciona en forma de oxidación debido a la liberación de electrones. El cátodo o polo positivo sufre una reducción de oxidación debido a la ganancia de electrones.
|
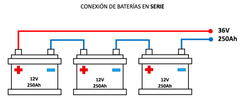
Conexión en serie
|
Si conectamos celdas energéticas en serie obtendremos un mayor voltaje Y se mantiene la
capacidad, los amperios. |
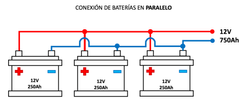
Conexión en paralelo
|
Si conectamos las celdas en paralelo aumentan los amperios, estaríamos aumentando la capacidad
de la batería y se mantendría el voltaje. |
|
Como es el viaje de electrones
|
viaja hacia el cátodo a través del circuito o aparato que sea conectado. Cuando los polos llegan a su limite el cátodo queda cargado de electrones y reducido, mientras que el ánodo los pierde y queda oxidado. Este proceso se puede revertir a través de una fuente de energía externa, ya que el exceso de electrones viaja hacia el lado positivo de la batería y la falta de estos en el polo negativo los cubre la batería.
|
|
Qué es "descarga lineal"
|
Durante toda la descarga, el voltaje de la batería varía poco, lo que evita la necesidad de circuitos reguladores. Esto es una ventaja, ya que hace muy fácil saber la carga que almacena la batería.
|
|
Qué es "efecto memoria"
|
Es un fenómeno que reduce la capacidad de las baterías con cargas incompletas. Se produce cuando se carga una batería sin haber sido descargada del todo.
La baterías solo suministra la energía añadida con con la última carga (lo que recuerda); la energía residual cargada anteriormente no esta disponible para su uso. |
|
Batería Ion-Litio
|
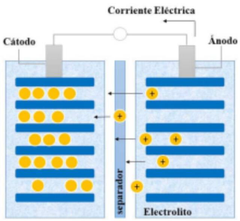
Batería que emplea como electrolito una sal de litio que procura los iones necesarios para la redox el cátodo (carbón poroso) y el ánodo (óxido de litio cobalto o de litio fosfato o de litio magnesio). Hay un separado entre el ánodo y el cátodo
|
|
Cómo funciona la batería litio
|
En la descarga, se produce una oxidación en el ánodo y una reducción en el cátodo. Los electrones viajan por el conductor donde el potencial será aprovechado. A su vez para mantener un equilibrio en la reacción los iones de Litio se transfieren del ánodo al cátodo por medio del separador.
Y al cargar la batería el proceso será inverso. |
|
¿porque se usan las baterías de litio?
|
Presentan gran relevancia en el mercado actual, ya sea en teléfonos inteligentes y en los coches eléctricos para la disminución de emisión de gases. Debido a la demanda en crecimiento diversos han sido los esfuerzos de la comunidad científica por mejorar el rendimiento y seguridad de las baterías de iones de litio.
|
|
Ventajas de las
baterías de Ion-Litio |
Elevada densidad de energía.
Poco peso. Alto voltaje por célula. Carecen de efecto memoria. Descarga lineal. Muy baja tasa de autodescarga. |
|
Desventajas de las
baterías de Ion-Litio |
Vida útil de unos 3 años.
Número limitado de cargas. Costosas. Peor capacidad de trabajo en frío. |
|
Dendritas de litio
|

Son pequeñas estructuras rígidas que crecen en
el interior. Estas formaciones pueden llegar a perforar el separador que evita que los electrodos se toquen. También aumentan las reacciones no deseadas en el electrolito acelerando los fallos de la batería. |
|
Impacto ambiental de las baterías de litio
|
El litio presente en las baterías dispuestas en los vertederos presenta diversos riesgos Por calentamiento intenso o en contacto con el agua puede ocasionar incendio o explosión. De la reacción con agua se forma gas de hidrógeno altamente inflamables y humos corrosivos de hidróxido de litio.
|
|
Batería de
Níquel-hidruro metálico (Ni-MH) |
Es un tipo de pila o batería recargable que utiliza un ánodo de oxihidróxido de níquel (NiOOH), como en la batería de níquel cadmio, pero cuyo cátodo es de una aleación de hidruro metálico.
|
|
Características
Batería Ni-MH |
Permite el almacenamiento de más energía.
Se encuentran menos afectadas por el efecto memoria. No usa metales tóxicos. |
|
Batería de sal fundida
|
Batería de alta temperatura de funcionamiento que usan la sal fundida como electrolito.
|
|
Batería Zebra
|
Batería de sal fundida que trabaja a una
temperatura de 250ºC. Emplea como electrolito Cloroalumiato de sodio triturado. Es una batería compleja de mayor contenido químico. |
|
¿Dónde se usan las baterías Zebra?
|
Son ideales para automóviles, autobuses, camiones e incluso trenes, debido a su posibilidad de operar con voltajes tan altos como 600 voltios.
|
|
Ventajas de la
batería Zebra |
- 100% reciclables.
- Bajo precio. - Alta energía específica. - Tiene el mejor ciclo de vida. |
|
Desventaja de las
baterías Zebra |
- En desuso, el electrolito se solidifica y necesita un tiempo de fundición (2 días) para que alcance la temperatura óptima y alcance su carga plenamente.
- Requieren mucho espacio. - Su potencia es relativamente baja |
|
Baterías de sodio
|
La batería de ion de sodio es un tipo de batería recargable que utiliza iones de sodio.
|
|
Ventaja de las
baterías de sodio |
- Elevado potencial reductor.
- Alta abundancia. - Reducido coste. - Muy poco impacto ambiental. |
|
Desventajas de las
baterías de sodio |
- Elevado peso atómico.
- Inferior voltaje de trabajo. - Menor capacidad especifica con respecto al litio. - Problemas de seguridad aunque menores que las baterías de litio. |