- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
33 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
Modelo atómico thomson definición y errores
|
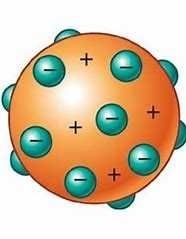
Budin de pasas
esfera positiva con carga negativa Errores: no existencia de núcleo,orbitales, protones ni neutrones ,etc Thomson también descubre el electrón |
|
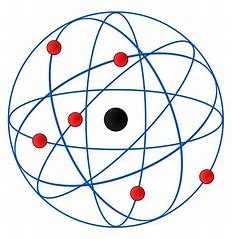
Modelo atómico rutherford definición y errores
|
Modelo nuclear,establece existencia del núcleo ,movilidad de electrones y establece que la mayor parte del átomo es espacio vacío
Errores: movimiento electrones no es correcto,carece de neutrones y tiene orbitales limitados. |
|
|
Modelo atómico de bohr definición y errores
|
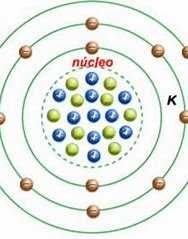
Modelo planetario
Establece :orbitales circulares según nivel energético,partículas que dan estabilidad en núcleo(neutrones) Errores: sólo aplicable al átomo de H por movimiento de electrones |
|
|
q establece el principio incertidumbre de Heisenberg ?
|

Establece que es imposible conocer simultáneamente la ubicación y el movimiento de un electrón (sólo aproximaciones )
|
|
|
Modelo Mecano cuanticos definición
|
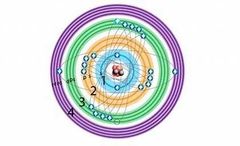
Modelo actual
Orbitales establecen probabilidad de encontrar un electrón en un sector determinado ( respondiendo al principio de incertidumbre) Energía presente en los electrones puede llevar al átomo a comportarse como una onda |
Modelo actual!!
|
|
Definición de átomo
|
Unidad de materia más pequeña, antiguamente se creía indivisible pero hoy se sabe que posee partículas subatómicas ( protones,electrones y neutrones)
|
|
|
Número atómico (Z) y número masico (A)
|
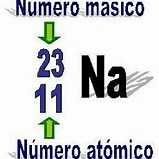
Número atómico (+pequeño) : cantidad de protones de un átomo
Número masico (+grande): suma de protones y neutrones del átomo |
|
|
Qué es un isótoPo?
|
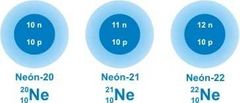
IsótoPos son atomos que poseen igual número atómico (p+) y distinto número masico
👀SIEMPRE SON DEL MISMO ELEMENTO |
Cantidad de protones:)
|
|
Qué es un isóbAro?
|
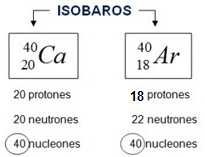
Átomos que poseen igual número masico (n y p+) y distinto número atómico (p+)
👀SIEMPRE ENTRE ELEMENTOS DISTINTOS! |
Igual nada nuclear:)
|
|
Qué es un isótoNo?
|
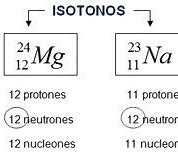
Átomos con distinto número masico ( n y p+) y distinto número atómico (p+) pero igual cantidad de neutrones
👀 SIEMPRE EN ELEMENTOS DISTINTOS! |
Cantidad de Neutrones
|
|
Cationes y aniones : diferencias
|
Iones positivos (Cationes) :mayor número de protones y menor número de electrones (p+>e-)
Iones negativos (Aniones): mayor número de electrones y menor número de protones (e->p+) |
Positivo se resta electrones
Negativo se suman electrones |
|
Número cuantico principal o
energético (n) |
Indica la energía de los orbitales y cercanía con el núcleo ( - energía + cerca del núcleo)
|
Número grande de la configuración electrónica
|
|
Números cuanticos función
|
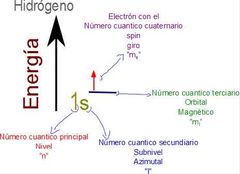
Identificar electrón más probable de encontrar en un lugar (son como coordenadas)
1 número cuantico principal(n) 2 número "" azimutal ( l) 3 número "" magnético ( m) 4 Spin (s) |
Precisar las aproximaciones del modelo Mecano cuantico
|
|
Número cuantico secundario o azimutal (l)
|
Indica la forma del orbital
dependen del orbital,si el orbital es : s=0 p=1 d=2 f=3 |
|
|
Número cuantico magnético (m)
|
Indica la orientación del orbital
Va de -l a +l ( siempre pasando por cero) |
Cuadraditos de flechas *
|
|
Número cuantico Spin (s)
|
Indica el sentido de rotación del orbital
Si la flecha queda indicando hacia arriba el valor será de +1\2 Si la flecha queda indicando hacia abajo el valor será de -1\2 |
|
|
Qué dice el principio d exclusión de pauli?
|
Establece que 2 electrones no pueden tener los mismos números cuanticos (debe variar al menos el spin)
|
Principio 1 de la configuración electrónica
|
|
Qué dice la regla de Hund?
|
Establece que un elemento es más estable si tiene más electrones paralelos ( desapareados)
|
Principio 3 de configuración electrónica
|
|
Regla del Octeto
|
Los electrones se comparten o se transfieren con !a intención de completar el Octeto ( configuración electrónica de los gases nobles) o hasta completar 1 par ( configuración electrónica del Helio)
👀 está regla se cumple por medio de la formación de enlaces |
|
|
Enlace ionico
|
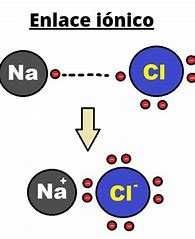
Diferencia de electronegatividad ≥1.67
Transferencia de electrones Se da entre metales y no metales |
|
|
Características de los compuestos ionicos:
|
* forman redes cristalinas
* Conducen corriente eléctrica en disolución acuosa o fundidos *sólidos a temperatura ambiente * Altos puntos de fusión y ebullición |
|
|
Enlace covalente
|
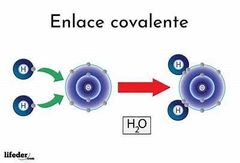
Diferencia de electronegatividad < 1.67
Compartición de electrones Unión de no metales |
|
|
Características de los compuestos covalentes:
|
* aislantes de corriente y calor
* Se pueden encontrar en los 3 Estados de la materia *solubles en disolventes capilares |
|
|
clasificación de lo enlaces covalentes:
|
Polar: electronegatividad <1.67 (un átomo ejerce mayor atracción en los electrones del otro)
Apolar: electronegatividad =0 ( generalmente entre átomo del mismo elemento) Dativo o coordinado:un mismo átomo comparte 2 electrones (dador) y otro átomo recibe . También pueden ser simples,dobles o triples según cantidades de electrones a compartir. |
|
|
Enlace metálico
|
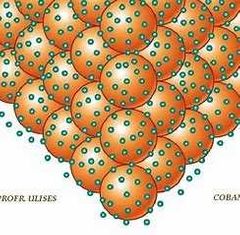
Enlace de posición no determinada
Se da entre 2 metales Núcleo de los atomos se unen formando una "red", electrones están libres en torno a la red positiva formando "mar de electrones" |
|
|
Características de los compuestos metalicos:
|
*buenos conductores del calor y la electricidad
* Muy brillantes * Sólidos a temperatura ambiente * Poseen nube electrónica de gran movilidad |
|
|
Geometría molecular lineal caracteristicas:
|
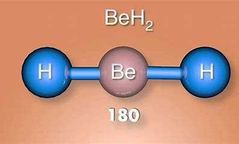
Fórmula AX2
Átomo central no tiene electrones desamparados Hibridación sp Ángulo de 180° Átomo menos electronegativo siempre es el átomo central(menos en caso del H) |
|
|
Geometría molecular trigonal plana:
|
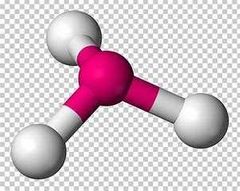
Fórmula AX3
Átomo central sin electrones libres Ángulo de 120° Hibridación SP2 |
|
|
Geometría molecular tetraédrica :
|
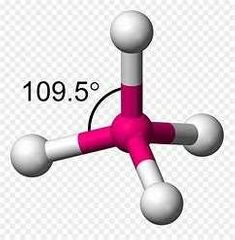
Fórmula AX4
Átomo central sin electrones libres Ángulo de 109,5° Hibridación sp3 |
|
|
Geometría molecular piramidal trigonal:
|
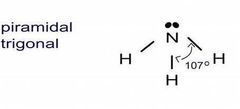
Fórmula AX3E
Átomo central tiene 1 par de electrones no enlazante Ángulo de 107° aprox 👀 pares no enlazantes generan mayor repulsión |
|
|
Geometría molecular Angular
|
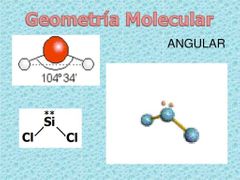
Fórmula AX3E2
Átomo central tiene 2 pares de electrones no enlazaba Ángulo de 104,5° aprox |
Molecula de agua tiene esta geometría
|
|
Fuerzas Van Der Waals:
Dipolo- dipolo dipolo inducido Dispersión de London |
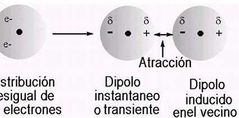
Dipolo- dipolo:entre moléculas apolares (entre + y -)
Dipolo inducido :interacción por carga en moléculas apolares e ion con carga (dipolo inducido es temporal) Fuerza dispersión de London: se da entre moléculas apolares , atracción entre molécula apolsres y dipolo inducido (atracción más débil de todas) |
|
|
Enlaces puente Hidrógeno
|
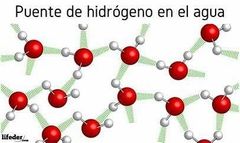
Se da entre un Hidrógeno y un átomo muy electronegativo (H-F, H-N,H-O)
👀 es sólo entre moleculas! (+fuerte) * Aplica en la tensión superficial del agua |