- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
44 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
Mol
|
Magnitud física que contempla el Sistema Internacional de Unidades.
Sirve para medir la cantidad de sustancia que contiene determinado número de entidades elementales (átomos, moléculas,..) |
|
|
Soluciones
|
Mezcla homogénea de una o más sustancias disueltas en otra sustancia
Compuesto por soluto y solvente Se presentan de forma líquida, física y gaseosa Conocer la concentración en una solución es importante porque determina cdad de soluto y solvente usados |
|
|
Soluto
|
Sustancia que se disuelve en una solución
|
|
|
Solvente
|
El que disuelve la sustancia (al soluto) en una solución
|
|
|
Tipos de soluciones
|
Se dividen según el grado de solubilidad del soluto en el solvente (disoluciones)
Pueden ser Diluidas (más solvente que soluto) Concentradas (equilibrado) Saturadas (más soluto que solvente) |
|
|
Disolución
|
Mezcla homogénea formada por sustancias puras que no reaccionan entre sí
Está formada por un disolvente y uno o + solutos |
|
|
Reacciones
|
Proceso en que dos o más sustancias se transforman creando nuevos elementos
|
|
|
Ecuación química
|
Son representaciones simbólicas de las reacciones químicas. Se componen de dos miembros, separados por una flecha que indica el sentido en que ocurre la reacción.
|
|
|
Ejemplos de reacciones
|
Fotosíntesis
Digestión de alimentos |
|
|
Tipos de reacciones
|
1- Reacción de síntesis o adición
2- Reacción de combustión 3- Reacción de descomposición 4- Reacción de precipitación 5- Reacción de neutralización (ácido base) 6- Reacción de óxido reducción |
|
|
Reacción de síntesis o adición
|
2 o + más elementos se combinan formando uno solo.
Durante el proceso de formación el doble o triple enlace se rompe formando otros enlaces A + B → AB Fe + S → FeS |
|
|
Reacción de combustión
|
Consiste en una sustancia reaccionando con oxígeno, produciendo luz🌠 y calor🔥🌡️
Siempre es exotérmico Una combustión completa requiere bastante oxígeno En las reacciones de oxidación el O normalmente es limitado y da combustión incompleta, por lo que resulta en varios componentes Ej compuesto orgánico: CH4 4 2O2 →2H2O + CO2 |
|
|
Reacción de descomposición
|
Implica romper una sustancia en compuestos más simples
Es opuesta a la reacción por síntesis Puede ocurrir de forma instantánea o por un catalizador, calor o electrolisis Ej: agua oxigenada (H2O2) AB →A + B 2H2O2 → 2H2O + O2 |
|
|
Reacción de precipitación
|
Un compuesto acuoso reacciona y forma un sólido
Dependiendo de la solubilidad de los compuestos iónicos puede precipitar o quedar suspendido en la disolución AB + CD → AD + BC |
|
|
Reacción de neutralización (Ácido base)
|
Aquella en la que interviene un ácido y una base
NaOH + HCl → NaCl + H2O |
|
|
Reacción de óxido reducción
|
Se produce un intercambio de electrones cambiando el estado de oxidación de los elementos
Un elemento pierde electrones (oxidándose) y el otro los gana (reduciéndose) Se da en múltiples procesos (oxidación de metales) 4Fe + 3O2 + 2H2O → 2Fe2O4・ H2O |
|
|
Estequiometría
|
Rama específica de la química que se centra en el estudio de las reacciones que se producen en diferentes sustancias y que pueden expresarse por una reacción química
|
|
|
Partes de una ecuación química
|
Reactivo (del lado izquierdo) y producto (del lado derecho)
|
|
|
Reglas para determinar # de oxidación 1
|
Los elementos libres tienen no. de oxidación 0
Ej: H° Cl° O2° K° |
Elementos libres
|
|
Reglas para determinar # de oxidación 2
|
En los iones simples el # de oxidación es igual a la carga del guión
Grupo IA →+1 Grupo IIA →+2 Grupo IIIA → +3 |
Iones simples
|
|
Reglas para determinar # de oxidación 3
|
Siempre es -2
Ej: H2O^ -² Excepto en los peróxidos, pues ahí es -1 Ej: H2O2^-¹ |
Oxígeno
|
|
Reglas para determinar # de oxidación 4
|
El H tiene # de oxidación de +1
Ej: H3^+¹PO4 EXCEPTO: los hidruros (metal y no metal) tienen # de 0 de -1 Ej: NaH^-¹ |
Hidrógeno
|
|
Reglas para determinar # de oxidación 5
|
En una molécula neutra los #s de oxidación suman 0
|
Molécula neutra
|
|
Reglas para determinar # de oxidación 6
|
En los guiones complejos los #s de oxidación deben de suma la carga del guión
|
Guiones complejos
|
|
Factores que afectan la viscosidad de una función
|
1. Naturaleza de la reacción
2. Concentración 3. Precisión 4. Orden 5. Temperatura 6. Solvente 7. Intensidad de la luz 8. Catalizador 9. Mezclado |
|
|
Simbología +
|
Añadido
Que una o más sustancias de combinan |
|

Simbología
|
Producto sólido o precipitado
|
|
|
Simbología →
|
Lo que produce o dirección de la reacción
|
|
Simbología
|
Acción reversible
|
|
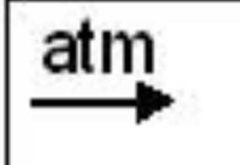
Simbología
|
Reacción que se somete a calentamiento
|
|
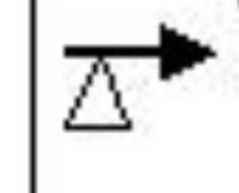
Simbología
|
Señala la presión en atmósfera en la cual se lleva la reacción
|
|
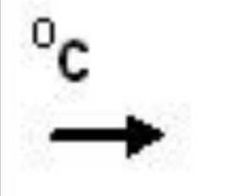
Simbología
|
Reacción a la que interviene la temperatura a grados centígrados
|
|
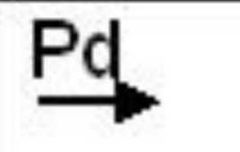
Simbología
|
Reacción que utiliza catalizador
|
|
|
Simbología (AC)
|
Acuoso (o solución disuelta en agua)
|
|
|
Simbología (S)
|
Sólido
|
|
|
Simbología (L)
|
Líquido
|
|
|
Simbología (G)
|
Gas
|
|

Simbología
|
Producto gaseoso
|
|
|
Ejemplo de reacciones químicas cotidianas
|
Combustión de gas propano en la estufa
Oxidación de un objeto de hierro Al encender cerrillo (fósforo y oxígeno) |
|
|
Ley de la conservación de la masa
|
Descubierta por Antoine Lavoisier
La cdad de materia antes y después de una reacción siempre es la misma. Preciso para reacciones de baja energía pero no para reacciones nucleares o colisiones |
|
|
Ley de proporciones definidas
|
Establecida por Joseph Proust
Afirma que muestras de un compuesto siempre tendrán la misma proporción de elementos de masa. Un átomo de un elemento en particular es el mismo que cualquier otro átomo del mismo elemento. Cada muestra tiene la misma composición |
|
|
Ley de proporciones múltiples
|
"si 2 elementos forman +mas de un compuesto cuando se relacionan entre sí, entonces la proporción de masas es igual a una relación de números enteros pequeños"
|
|
|
Qué es ácido base
|
Reacción que ocurre entre un ácido y una base dando como resultado una sal y agua (h2o)
Son generalmente exotérmicas (desprenden calor) Se le llama de neutralización pq al reaccionar el ácido y base estos neutralizan sus propiedades mutuamente |
|
|
Métodos se balanceo
|
Método de balanceo por óxido reducción
Método algebraico Método por tanteo |