- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
9 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
isómeros
|
moléculas que tienen la misma fórmula química pero diferente conformación molecular.
|
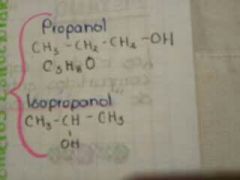
|
|
estructura de Lewis
|
forma de simbolizar el enlace en una molécula covalente. El e^ de Valencia (punto) y el enlace (línea). Las moléculas tratan de tener su configuración como la del gas noble más cercano.
|
|
|
e^ no enlazantes
|
Son los que no son compartidos entre dos atomos y cuando son un par son conocidos como "pares solitarios"
|
|
|
elementos con e^ no enlazantes
|
flúor, cloro, bromo, yodo, oxígeno, nitrógeno.
|
|
|
enlace covalente no polar
|
e^ igualmente compartidos por los dos atomos
|

|
|
enlace covalente polar
|
el e^ va a pasar más tiempo por el elemento más pesado
|

|
|
electronegatividad
|
H 2.2
Li 1 Na 0.9 K 0.8 Be 1.6 Mg 1.3 B 1.8 Al 1.6 N 3 P 2.2 O 3.4 S 2.6 F 4 Cl 3.2 Br 3 I 2.7 |
|
|
cargas formales
|
método de seguimiento que permite determinar que atomos tienen mayor carga dentro de una molécula.
|
|
|
híbridos de resonancia
|
molécula real.
las estructuras de resonancia son las diferentes formas.de representar un mismo ismo comouedrob |