- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
14 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
Átomo
|
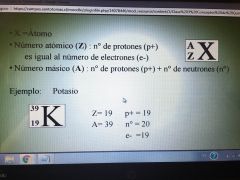
Partícula más pequeña con que se puede encontrar la materia de forma estable.
|
Núcleo:
Protones: Carga positiva Neutrones: Carga neutra Corteza: Electrones: Carga negativa |
|
Isótopo
|
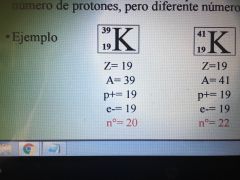
Átomos de un mismo elemento químico con el mismo número de protones, pero diferente número de neutrones.
|
Tipos de isótopos:
Naturales o artificiales, estables o inestables. Isótopos inestables: Liberan energía y son también llamados radioisótopos o radioactivos. Estos permiten estimar la edad aproximada de muestras que contengan el isótopo. |
|
Ión
|
Átomo que al perder o ganar electrones queda cargado eléctricamente.
|
Catión: Ión de carga positiva (+), con un electrón menos.
Anión: Ión de carga negativa (-), con un electrón más. |
|
Elemento
|
Sustancia que no puede separarse en sustancias más sencillas. Está formado por átomos y posee un Z determinado.
|
Ejemplo: H, O, N
|
|
Molécula
|
Partícula más pequeña que presenta todas las propiedades de una sustancia. Está formada por dos o más átomos iguales o diferentes.
|
Ejemplo: O2, H2O, NaCl, HCl
|
|
Enlaces químicos
|
Los enlaces son la unión de dos o más átomos que ocurren al ceder, captar o compartir electrones para lograr la estabilidad en la última capa.
Ley de octeto. |
|
|
Enlace covalente
|

Enlace covalente: Dos átomos comparten pares de electrones. Tienen baja electronegatividad. Son enlaces fuertes.
|
Pueden ser sólidos, líquidos o gaseosos a T ambiente. Baja T de ebullición y fusión. Insolubles en agua pero solubles en compuestos apolares.
Aislantes. |
|
Enlace iónico
|
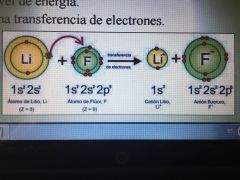
Unión electroestática entre dos iones de cargas opuestas.
Se unen metales (I, II, III A) y no metales ( V, VI, VII A) en el último nivel de energía. Existe una transferencia de electrones. |
Sólidos a T ambiente.
Son cristalinos y resistentes (duros). Solubles en agua. Altos puntos de fusión y ebullición. Conducen corriente eléctrica. |
|
Interacción hidrofóbica
|
Ocurre cuando moléculas apolares (hidrofóbicas) tienden a agruparse en medios acuosos.
|
Hidrofílocos (polar): Compuestos que se disuelven fácilmente en agua.
Hidrofóbicos (apolar): Compuestos que no se disuelven en agua pero si en compuestos apolares como el cloroformo y el benceno. Anfipáticos: Compuestos que contienen regiones polares y apolares (proteínas y aminoácidos) |
|
Puentes de hidrógeno
|
Ocurre entre un átomo electronegativo (N, O, F) y un hidrógeno de la molécula siguiente.
Existen un dador de H y un aceptor. |
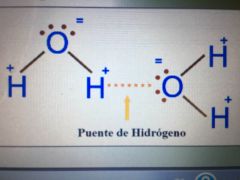
Ejemplo: H2O, NH3
|
|
Fuerzas de van der Waals
|
Son fuerzas de estabilización molecular entre molécula-molécula.
Ocurre entre moléculas con baja polaridad. Se genera por movimiento de los electrones. Incluyen atracciones entre átomos, moléculas y superficies fuera de los enlaces normales. |
|
|
Fuerzas dipolo-diopolo
|
Se forma entre un dipolo positivo de una molécula polar con el dipolo negativo de otra polar.
|
Ejemplos: Metanol (CH3OH) y glucosa (C6H12O6)
|
|
Fuerza de dispersión
|
Es la atracción entre los extremos positivo y negativo de dipolos inducidos en moléculas adyacentes.
En las moléculas apolares puede producirse un desplazamiento relativo de los electrones, originando un polo positivo y otro negativo (dipolo transitorio) que determinan una atracción entre dichas moléculas. |
|
|
Interacción iónica
|
Ocurre entre iones de carga eléctrica neta.
Grupo funcionales cargados (carboxilo COO-. amino NH2) y en iones inorgánicos. Pueden ser de atracción como de repulsión. Ocurre en biomoléculas. |