- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
![]()
![]()
30 Cartas en este set
- Frente
- Atrás
LA NOMENCLATURA
|
Es un número entero asignado a un elemento, cuando forma parte de un compuesto. Indica el poder de combinación de un elemento. NOMENCLATURA: Propone dar un nombre a cada sustancia compuesta.
|
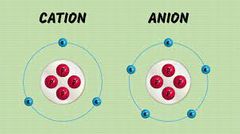
IONES:
|
Los Iones son átomos o grupos de átomos que han perdido o han ganado electrones, por lo que tienen carga eléctrica neta.
Estos pueden ser monoatómicos y poliatómicos. |
IONES MONOATOMICOS:
|
Un ion monoatómico es un ion formado por un átomo, a diferencia de un ion poliatómico que consiste de dos o más átomos. Por ejemplo, el carbonato de calcio consiste en el ion monatómico Ca²⁺ y el ion politómico CO₃²⁻.
|
|
IONES POLIATOMICOS:
|
Un ion poliatómico, también conocido como ion molecular, es un ion compuesto por dos o más átomos covalentemente enlazados o de un complejo metálico que puede considerarse como una sola unidad en el contexto de química de ácidos y bases o en la formación de sales.
|
|
MOLECULAS:
|
En química, una molécula es un grupo eléctricamente neutro y suficientemente estable de al menos dos átomos en una configuración definida, unidos por enlaces químicos fuertes covalentes.En este estricto sentido, las moléculas se diferencian de los iones poliatómicos.
|
|
ESTADOS DE OXIDACION:
|
El número de oxidación está determinado por las siguientes reglas: El número de oxidación de cualquier átomo sin combinar o elemento libre (por ejemplo, N2 ) es cero. El número de oxidación para el oxígeno es – 2 (en los peróxidos es de – 1). El número de oxidación para el hidrógeno es +1 (en los hidruros es de – 1).
|
|
RELACION DE LA TABLA
PERIÓDICA Y LOS NUMEROS DE OXIDACION |
Existe una gran relación entre los números de oxidación y la configuración electrónica de los elementos. Todos los elementos del grupo IA tiene número de oxidación +1, los elementos del grupo IIA tienen número de oxidación +2 y así sucesivamente.
|
|
Números de oxidación y
Predicción de fórmulas: |
Existen algunas reglas útiles basadas en el concepto del número de oxidación que permiten predecir las fórmulas de un gran número de compuestos.
Una de las propiedades más importantes de los elementos es su estado de oxidación, o número de oxidación. El número de oxidación está determinado por las siguientes reglas: El número de oxidación de cualquier átomo sin combinar o elemento libre (por ejemplo, ) es cero. El número de oxidación para el oxígeno es – 2 (en los peróxidos es de – 1). El número de oxidación para el hidrógeno es +1 (en los hidruros es de – 1). Para iones simples, el número de oxidación es igual a la carga del ión. (Así, para Ba2+ el número de oxidación es + 2.) La suma de los números de oxidación para los átomos de los elementos en una fórmula determinada es igual a cero; en el caso de un ion poliatómico la suma es igual a la carga total. (Un ion poliatómico es una partícula cargada que contiene más de un átomo, por ejemplo, el ion . |
|
Sustancias compuestas: el nombre de
una sustancia compuesta se forma de dos partes: Nombre genérico y nombre específico. |
El nombre genérico es l a primera pal abra y señal a una
característica general de un grupo relativamente grande de sustancias, por ejemplo: Ácido, Hidróxido El nombre específico es l a segunda pal abra y como su nombre l o indica señal a una característica que permite diferenciar a una sustancia de las demás del grupo a que pertenece |
|
Las sustancias compuestas se
nombran bajo tres sistemas: |
1. Sistema clásico o funcional
Sigue fundamentalmente las normas dadas por la primera comisión que estudiara el problema. S e usará para todos los compuestos . 2. Sistema Estequiométrico Señala las proporciones de los integrantes de un compuesto usando prefijos griegos a latinos , mono (generalmente s e omite) di, tri, tetra, penta, hexa, hepta, octa, nona, deca, etc. 3. Sistema stock En es te sistema s e señala la proporción con números romano |
|
Para facilidad de estudio, las sustancias compuestas
se dividen en grupos de acuerdo al número de ELEMENTOS DIFERENTES que los formen, independientemente del número de átomos que de cada uno intervengan. Los grupos son: |
Binarios : Compuestos formados por dos elementos
Ejemplo H 2 O Ternarios : Compuestos formados por tres elementos Ejemplo: KOH Cuaternarios : Compuestos formados por cuatro elementos . Ejemplo: NaHCO 3 |
|
COMPUESTOS
BINARIOS |
En las fórmulas de los compuestos
binarios se debe escribir adelante el elemento más electropositivo o el menos electronegativo. |
|
I. Compuestos
Binarios Oxigenados: |
En el sistema clásico o funcional los
compuestos binarios oxigenados se dividen en dos grupos: |
|
ÓXIDOS:
|
Producto de la reacción
del oxígeno con un metal. |
|
ANHÍDRIDO:
|
Producto de la reacción del oxígeno con u n n o metal y
con algunos metales de transición . (Óxidos ácidos). En los sistemas estequiométrico y Stock todos los compuestos binarios oxigenados son óxidos. |
|
A. ÓXIDOS: En el sistema clásico el
nombre genérico es óxido y para el nombre específico se presentan dos casos: |
1. Que el metal tenga s olo un número de oxidación, es decir, que forme s olamente
un óxido. En es te cas o el nombre es pecífico es el del metal contraído y terminado en “ico” o anteponiendo la palabra “de” al nombre del metal. Ejemplo: Na 2 O óxido de s odio u óxido sódico CaO óxido de calcio u óxido cálcico 2. Que el metal tenga dos números de oxidación. En es te cas o, el nombre específico lo constituye el del metal contraído y |
|
La nomenclatura en “oso” e “ico”
tiende a extinguirse por lo que actualmente se aplican más los sistemas estequiométrico y Stock ejemplos: |
Sistema Estequiométrico --- Sistema Stock
FeO óxido de hierro ---- óxido de hierro (II) Fe 2 O 3 trióxido de di hierro---óxido de hierro (III) |
|
Dado el nombre de un
óxido escribir su fórmula: |
1. S e es criba primero el símbolo del metal por ser el electro positivo.
2. S e establecen los números de oxidación y s e siguen los pasos establecidos en la predicción de fórmulas . Ejemplos : I. Oxido de s odio +1 -2 Na 2 O Na O |
|
II Oxido mercúrico
|
El metal es el mercurio que tiene números de oxidación +1 y +2, como s e trata de
la terminación “ico” que es para el mayor, s e tiene: +2 -2 Hg 0* Es tos números entre cruzados , serán los subíndices de los elementos , como son divisibles por un mismo factor, entonces s e efectúa la división y la fórmula será HgO. |
|
Dada la fórmula de un
óxido escribir su nombre: |
Como en los óxidos el oxígeno siempre actúa con -2 s e multiplica el subíndice del
oxígeno por es te valor y s e calcula el número de oxidación del metal teniendo pres ente que la suma algebraica debe ser cero. Ejemplos : +4 -2 Pb + O = PbO 2 Como el plomo tiene estados de oxidación +2 y +4, el nombre del compuesto será: Sistema clásico--Oxido plúmbico Sistema estequiométrico---dióxido de plomo Sistema Stock----óxido de plomo (IV) II. + |
|
B) ANHÍDRIDOS:
|
Producto de la reacción del oxígeno con un elemento no metálico y con algunos
metales de transición. En general puede decirse que forman anhídridos los no metales de las columnas IV A y VI A cuando trabajan con números de oxidación PARES . Cuando lo hacen con impares s i los tuvieran, forman óxidos . Los no metales de las familias V A y VII A, forman anhídridos cuando trabajan con números de oxidación IMPARES , y forman óxidos cuando lo h |
|
Nombre genérico: anhídrido
Nombre específico: se presentan dos casos |
Nombre específico: se presentan dos casos
1. Que el elemento solo forme un anhídrido. El nombre específico s e forma con el nombre del no metal terminado en “ico”, ejemplo: CO 2 anhídrido carbónico 2. Que el elemento forme más de dos anhídridos . En es te cas o el nombre específico se forma con el nombre del no metal con prefijos y sufijos que indican los números de oxidación positivos . |
|
Ejemplo: Escribir la fórmula del anhídrido clórico.
Como la terminaciones ICO, al no metal corresponde número de oxi dación+5 o +6. El elemento no metálico es el cl oro y pertenece a l a columna VIIA, por l o tanto ti ene que funcionar con el número de oxi dación impar o sea +5. |
La fórmula s erá:
+5 -2 Cl + O Cl 2 O 5 Dada la fórmula de un anhídrido es cribir s u nombre. Ejemplo: Es cribir el nombre de S O 3 . 1. El az ufre (S ) no metal de la columna VI A debe tener número de oxidación PAR. 1. S e puede calcular el número de oxidación del no metal de la manera siguiente: a) El subíndice del oxígeno s e multiplica por -2: 3(-2) = -6 b) El producto con signo cambiado s e divide por el subíndice del no metal: 6 / 1 = 6 |
|
d. PEROXIDOS:
|
d. PEROXIDOS:
Se forman de la combinación del oxígeno con los metales alcalinos y alcalinotérreos más activos y con el hidrógeno. |
|
Característica: en estos compuestos el
oxígeno actúa con número de oxidación -1. |
NOMENCLATURA
Nombre genérico: Peróxido Nombre específico: El nombre del metal precedido de la palabra “de”. Ejemplos : H 2 O 2 Peróxido de hidrógeno (agua oxigenada) Na 2 O 2 Peróxido de s odio BaO 2 Peróxido de bario |
|
II Compuestos Binarios
Hidrogenados: |
a) HIDRUROS : Compuestos binarios de elementos representativos de los grupos I
A, II A Y III A con el hidrógeno (con excepción del boro) y con elementos de transición. Característica principal: El hidrógeno actúa con número de oxidación -1. Nombre genérico: Hidruro Nombre específico: El del metal en genitivo o adjetivado, s i solo forma un hidruro, s i no el nombre del metal terminado en os o o en ico según actúe con s u menor o mayor número |
|
III Compuestos Binarios sin
Oxígeno y sin hidrógeno. |
Metal - no metal: s ales haloideas
No metal - no metal Metal - mercurio: amalgamas Metal - metal: aleaciones a) Compues tos formados por un metal y un no metal: S ales Haloideas . Es tos compues tos res ultan de la s us titución total de los hidrógenos en los hidrácidos por metales . Nombre genérico: el del no metal terminado en “URO”. Nombre específico: el del metal Pueden usarse los tres sistemas Ejemplos : --------Clásico-Estequiométrico-Stock |
|
COMPUESTOS
TERNARIOS |
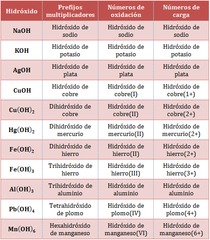
Hidróxidos o Bas es :
Un hidróxido es el producto de la reacción de un óxido básico con el agua. CaO + H 2 O -------- > Ca (OH) 2 Na 2 O + H 2 O --------> 2Na OH Puede definir s e como una sustancia que en soluciónacuos a produce iones hidroxilo. “OH” o sustancias aceptoras de protones . S e estudian en los sistemas clásicos y Stock. |
|
Sistema Clásico:
|
Emplea diversos sufijos y prefijos (como -oso, -ico, hipo-, per-) según la valencia atómica de los elementos del compuesto. Este sistema de nomenclatura se encuentra mayormente en desuso. Por ejemplo: El compuesto Ni2O3 se llama óxido niquélico.
|
|
Sistema Stock:
|
Resultan de la combinación del oxígeno con metales y al reaccionar con el agua producen bases. Se nombra con la palabra genérica óxido seguido de la preposición de enseguida el nombre del metal con el que se combinó, por ejemplo: óxido de calcio.
|