- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
301 Cartas en este set
- Frente
- Atrás
|
identifica cuál de los siguientes enunciados es un cambio químico
|
oxidación del azufre
|
|
son enunciados verdaderos
|
*todo compuesto es una sustancia
*cada compuesto contiene dos o más elementos * cada mezcla contiene dos o más sustancias |
|
en cuál de las siguientes opciones hay únicamente elementos
|
* Na (g), C2 (g), P4 (s).
|
|
su unión es química, tiene proporciones fijas y fórmula química.
|
compuesto
|
|
un compuesto es el
|
amoniaco (NH3)
|
|
cuál de las siguientes sustancias es un compuesto?
|
CO
|
|
son ejemplos de compuestos
|
*cloruro de sodio (NaCl)
*hidróxido de potasio (KOH) *agua (H2O) |
|
identifica el compuesto
|
metano ( CH4 )
|
|
(+)(+) elemento que se utiliza para hacer bombas
|
azufre. (S)
|
|
los siguientes materiales indica cuáles son compuestos:
|
*carbonato de calcio (CaCO3)
*ácido sulfúrico (H2SO4) *cloruro de sodio (NaCl) |
|
su unión es física, sus componentes no tienen una relación química y no pierden sus propiedades originales.
|
mezcla
|
|
sustancia formada por varios ingredientes que no se distinguen a simple vista.
|
mezcla homogénea.
|
|
de sólido a gaseoso es:
|
sublimación
|
|
un ejemplo de sublimación es:
|
el yodo
▪️▪️▪️▪️▪️( sólido) ... + energía ( calor) = gaseoso 🌪️💨💨 |
|
el yodo es un ejemplo de sustancia que sublima
|
sublimación
|
|
( clase, recordatorio) ¿cuáles son cambios químicos?
|
cambio químico: donde se producen sustancias químicamente diferentes a las originales, son ireversibles.
oxidación: oxidación de la fruta cuando partes a la mitad un aguacate después de unos minutos se pone *****. combustión: cuando se quema algo se produce humo ( combustión). |
|
una disolución se considera como:
|
mezcla homogénea
|
|
un ejemplo de mezcla homogénea es:
|
el aire
|
|
una mezcla heterogénea:
|
se distingue a simple vista
|
|
cuál es el enunciado verdadero?
|
el cloruro de sodio es un compuesto y el aire es una mezcla
|
|
partícula subatómica con carga negativa
|
electrón
|
|
cuál delos siguientes enunciados sobre el átomo son verdaderos
|
*el átomo es eléctricamente neutro.
*el núcleo del átomo contiene protones y neutrones, los electrones están fuera de él. |
|
al comparar un neutrón con un electrón, un neutrón tiene:
|
una masa mucho mayor, pero sin carga
|
|
científico que en su teoría atómica propuso que los electrones se encuentran distribuidos en órbitas atómicas alrededor de un núcleo positivo.
|
Rutherford
|
|
la configuración electrónica del carbono es:
|
1s² 2s² 2p²
|
|
elige el inciso que muestra la relación de columnas correcta:
|
*modelo atómico de Bohr: los electrones giran alrededor del núcleo central cargado en niveles de energía bien cargados.
*modelo atómico de Rutherford: en el átomo están los electrones girando alrededor de un núcleo central cargado. *modelo atómico de dalton: el átomo es una partícula esférica indivisible. *modelo atómico de Thomson: el átomo debía ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones. |
|
qué cantidad de protones, electrones y neutrones tiene el átomo del elemento cuyo número atómico es de 25 y tiene un número de masa/másico de 55?
|
25, 25 y 30.
|
|
un átomo con un número atómico de 25 y un número de masa de 55 tiene ___________ protones, ________electrones y ________ neutrones.
|
25,25 y 30.
respuesta completa: un átomo con un número atómico de 25 y un número de masa de 55 tiene 25 protones, 25 electrones y 30 neutrones. |

La siguiente tabla describe cuatro átomos diferentes con el número de protones, electrones y neutrones que contiene cada uno.
|
En relación con ellos es cierto que:
*La masa atómica del C es 22. |
|
A continuación, se presentan elementos químicos con números entre paréntesis que indican su número atómico. Argón (18), Potasio (19), calcio (20) y niquel (28). De acuerdo con la información, ¿qué enunciado es verdadero?
|
Un núcleo de calcio contiene más protones que un núcleo de argón.
|
|
La configuración electrónica del carbono es:
|
1s², 2s², 2p²
|
|
¿Cuál es la configuración del potasio z=19 y A=39?
|
1s², 2s², 2p⁶, 3s²,3p⁶,4s¹
|
|
El número de neutrones que hay en el ión 35/17 Cl es:
|
18
|
|
qué elemento tiene la siguiente estructura atómica?
1s²,2s²,2p⁶,3s² |
magnesio
|
|
el elemento con número atómico 17 y configuración electrónica 1s² 2s² 2p⁶ 3s² 3p⁶ se clasifica en la familia:
|
VIIA
|
|
la configuración electrónica del carbono es 1s² 2s² 2p², por lo tanto se encuentra en el período __________ y familia _________.
|
2- IV
|
|
la configuración electrónica de cierto elemento es 1s² 2s² 2p⁴ para que adquiera la configuración electrónica de un gas noble se debe:
|
agregar dos electrones a 2p⁴
|
|
la configuración de 1s² 2s² 2p⁴. qué le falta para que cumple la regla del octeto
|
agregar 2e a 2p⁴
|
|
los electrones de valencia son:
|
electrones de la capa más alejada del núcleo.
|
|
en la naturaleza, el cloro presenta 2 isótopos estables. la diferencia entre ellos radica en el número de:
|
neutrones
|
|
en la tabla periódica, los elementos con propiedades similares están ordenados por columnas verticales llamadas:
|
grupos
|
|
son dos características de los metales
|
maleables y buenos conductores de calor
|
|
¿cuál de los siguientes grupos de elementos contiene UN no- metal y un semimetal (metaloide)?
|
Li,Ag, Sb y S.
|
|
los metales para cumplir la regla del octeto deben
|
ceder electrones
|

Cuál es la estructura de Lewis de SnCl2
|
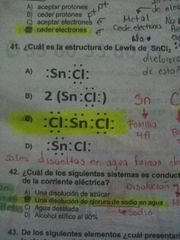
|
|
¿cuál de los siguientes sistemas es conductor de la corriente eléctrica?
|
una disolución de cloruro de sodio en agua.
|

de los siguientes elementos cual presentaria la electronegatividad más alta
|
cloro
|
|
cuál elemento tiene la mayor energía de ionización?
|
Flúor
|
|
los elementos como el F y Cl son más
|
electronegativos
|
|
ordena los siguientes elementos Li, C, F, Ar en forma creciente de electronegatividad.
|
Ar< Li< C< F
|
|
¿cuáles son los elementos con mayor electronegatividad?
|
flúor, cloro, oxígeno.
|

¿Cuál reacción representa la formación de una sal?
|
HCI + KOH ------ KCI + H2O
|
|
La reacción entre un ácido inorgánico con una base nitrogenada, por lo general, se obtienen como productos:
|
Sal y agua
|

identifica que compuestos son óxidos ácidos
Na2O, SO2, SO3, CaO, FeO. |
SO2 y SO3
|

Clasifica las siguientes sales como (l) oxisales o (ll) binarias.
|

|
|
Las fórmulas del monóxido de carbono, hidróxido de magnesio y el sulfato de aluminio son respectivamente
|
CO -Mg (OH) 2 - Al2(SO4)3
|
|
La reacción, cuyos reactivos generan una sal binaria es:
|
metal + no metal.
|

Relaciona los siguientes compuestos:
|

l:C - ll:a - lll:b
|

Relaciona las siguientes columnas:
|

|
|
¿Cuál de los siguientes compuestos es un óxido básico?
|
CaO
|

¿Cuál de los siguientes compuestos son óxidos ácidos?
|

|
|
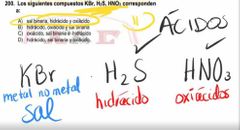
Los siguientes compuestos KBr, H2S, HNO3 corresponde a :
|
sal binaria, hidrácido y oxiácido
|
|
Selecciona el óxido ácido
(Nm + O) |
SO3
|
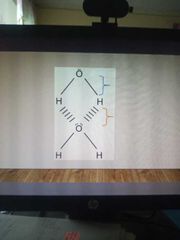
líneas discontinuas.
|
azul - fuerza interatomica - covalente polar
naranja- fuerza intermocular - puentes de hidrógeno |
|
Son los elementos más electronegativos
|
flour y oxígeno
|
|
Científico que en su teoría atómica propuso que los electrones se encuentran distribuidos en órbitas atómicas, alrededor de un núcleo positivo.
|
Rutherford
|
|
las fórmulas del monóxido de carbono, hidróxido de magnesio y el sulfato de aluminio son respectivamente.
|
CO- Mg (OH)2 - Al2(SO4)3
|
|
la reacción, cuyo reactivos generan una sal binaria es:
|
metal + no metal
|
|
relaciona los siguientes compuestos:
HNO3 ---- Ácido ( porque empieza con H) NaOH ---- Hidróxido ( tiene OH al final) KBr ----- sal ( M +NM) |
HNO3 ---- Ácido ( porque empieza con H)
NaOH ---- Hidróxido ( tiene OH al final) KBr ----- sal ( M +NM) |
|
relaciona las siguientes columnas:
Mg(OH)2 --- hidróxido de magnesio HClO4 ---- ácido perclórico HCl --- ácido clorhídrico MnO2 --- dióxido de maganeso |
Mg(OH)2 --- hidróxido de magnesio
HClO4 ---- ácido perclórico HCl --- ácido clorhídrico MnO2 --- dióxido de magneso |
|
Cuál delos siguientes compuestos es un óxido básico?
(Metal + Oxígeno) |
CaO
|
|
¿cuál de los siguientes compuestos son óxidos ácidos?
(No metal + Oxígeno) |
SO2
SO3 |
|
los siguientes compuestos KBr, H2S, HNO3 corresponden a:
|
sal binaria, hidrácido y oxiácido
|
|
selecciona al óxido ácido
(No metal + Oxígeno) |
SO3
|

la fórmula del dióxido de azufre es SO2.¿cuántos g se necesita para tener 6.022x10²³ ( no. de Avogadro) moléculas de SO2?
|
64 gramos
|
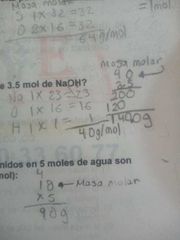
¿Cuál es la masa de 3.5 mol de NaOH?
|
140 g
|
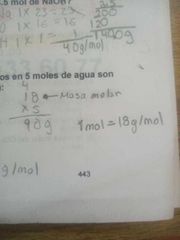
Los gramos contenidos en 5 moles de agua son (masa molar 18 g/mol):
|
90
|

el número de moles que contienen 147.1g de dicromato de potasio ( K2, Cr 2, O7), Masa molar de 294.2 g/ mol, es:
|
0.5
|

el vinagre es una disolución acuosa de ácido acético CH3- COOH ¿Cuál es la masa molecular de este compuesto?
|
60 g/ mol
|
|
ejemplo de ácidos fuertes
|
H2SO4- ácido sulfúrico
HNO3 - ácido nitrico HClO4 - ácido perclórico HCl - ácido clorhídrico HBr - ácido bromhidrico Hl - ácido yudhidrico |
|
según la teoría de Lewis una base es:
|
sustancias capaz de donar electrones (e–)
|
|
cuáles son los ácidos fuertes
|
H2SO4
HNO3 HClO4 HCI HBr Hl |
|
cuál es un ácido débil
|
CH3- COOH ácido acético ( vinagre)
|
|
beses fuertes
cuando el hidróxido va acompañado con un metal de la familia IA son bases fuertes |
todos los hidróxidos de la familia Al
hidróxido ( compuesto de OH y metal) ej: MOH SrOH |
|
cuando aumenta la escalas del pH los hidrogenos se hacen más chiquitos y los OH se hacen más grandes
|
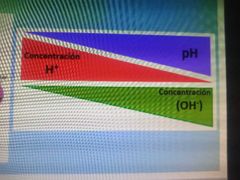
|
|
propiedad química de los metales alcalinos
|
son muy reactivos con el agua y al oxidarse pierde un electrón
|
|
Cuál de las siguientes sustancias es menos solubles en agua
|
CH4
|

para valorar un ácido débil se utilizó una base débil en indicador ácido- base el cual coloreo de amarillo al ácido¿ Cuál será el pH en el punto de equivalencia si se tiene una coloración roja?
|
6.4
|

cuáles las siguientes reacciones químicas corresponde a una reacción de combustión?
|
2C3H2 + 9O2 ---- 6CO2 + 2H2O
|

Cuál es la ecuación qué representa la formación de lluvia ácida por acción del ácido sulfúrico y carbonato de calcio
|
H2SO4+ CaCO3 = CaSO4 + CO2 + H2O
|
|
con respecto a los intercambios de energía en una reacción química ¿Cuál delos siguientes enunciados es verdadero?
|
en una reacción química se rompen y forman enlaces
|
|
selecciona al ácido óxido
|
SO3
|

Cuál es la masa de 3.5 mol de NaOH
|
140 g
|
|
El vinagre es una disolución acuosa de ácido acético CH3- COOH, ¿Cuál es la masa molecular de este compuesto?
|
60 g/ mol
|
|
Observa 2A + 3 B --- 2C + D
¿ Por cada mol de reactivo B que se consume se obtiene del producto c? |
2/3 mol
|
|
Calcula la masa molecular del bicarbonato de calcio Ca( HCO3)2
|
162
|

calcula la masa molecular del bicarbonato de calcio Ca(HCO3)2
|

162
|
|
El vinagre es una disolución acuosa la cual contiene ácido acético CH3-COOH calcula su masa molar.
|
60 g/mol
|
|
¿Cuál reacción representa la formación de una sal?
|
HCl + KOH ------ KCl + H2O
|
|
La reacción entre un ácido inorgánico con una base nitrogenada, por lo general, se obtienen como productos:
|
Sal y agua
|
|
Identifica qué compuestos son óxidos ácidos ( No metal + Oxígeno)
|
SO2 y SO3
|
|
Clasifica las siguientes sales como (l) oxisales o (ll) binarias
|
l: (oxisales)
Na2CO3 Na2SO4 CaCO3 ll: ( binarias) CaCl2 KF |
|
Las fórmulas del monóxido de carbono, hidróxido de magnesio y el sulfato de aluminio son respectivamente
|
CO - Mg(OH)2 - Al2( SO4)3
|
|
La reacción, cuyos reactivos generan una sal binaria es:
|
metal + no metal
|
|
Relaciona los siguientes compuestos:
|
HNO3 - Ácido
NaOH - Hidróxido KBr - Sal |
|
¿cuál de los siguientes compuestos es un ácido básico?
(metal+ oxígeno) |
CaO
|
|
¿Cuál de los siguientes compuestos son óxidos ácidos?
( No metal + oxígeno) |
SO2
So3 |
|
Los siguientes compuestos KBr, H2S, HNO3 corresponden a:
|
sal binaria, hidrácido y oxiácido
|
|
Para conocer la concentración de una sustancia expresada en términos de molaridad es necesario conocer el
|
Volúmen de disolvente, masa molar y la cantidad de soluto
|
|
La fórmula del dióxido de azufre es SO2, ¿cuántos g se necesita para tener 6.0022x10²³ moléculas de SO2?
|
64 gramos
|
|
¿Cuál es la masa de 3.5 mol de NaOH?
|
140 g
|
|
Los gramos contenidos en 5 moles de agua son ( masa molar 18g /mol):
|
90
|
|
Cuál de la siguientes sustancias es un ácido fuerte |
H2SO4 ( ácido sulfúrico)
|
|
ejemplos de ácidos fuertes
|
HCl y HNO3
|
|
el número de moles que contienen 147.1 g de dicromato de potasio ( K2,Cr2, O7), Masa Molar de 294.2 g/mol, es:
|

0.5
|

El vinagre una disolución acuosa de ácido acético CH3 -- COOH, ¿cuál es la masa molecular de este compuesto?
|
60 g/ mol
|
|
Observa 2A + 3B ➡️ 2C + D
¿Por cada mol de reactivo B que se consume se obtiene del producto C? |
2/3 mol
|
|
Calcula la masa molecular del bicarbonato de calcio Ca(HCO3)2
|

162
|
|
Una barra de metal oxidada es tallada con una lija y se obtienen 80g de Fe2O3 ¿Cuál es la cantidad de sustancia en mol que se obtiene?
|

0.5 mol
|
|
Referente a los siguientes ejemplos
CO, CO3, CO5 Se puede afirmar que |
la masa molar del CO5 es la mayor y la del CO es la menor.
|
|
De los siguientes contaminantes del aire se puede decir que _______ es el de mayor masa molar y _______ el de menor masa molar.
|
N2O5, NO
|
|
Una reacción de combustión del azufre es:
3S + 4O2 ➡️ SO2 + 2SO3 Al balancear la reacción, por cada mol de azufre se consumen ___________ moles de oxígeno gaseoso. |
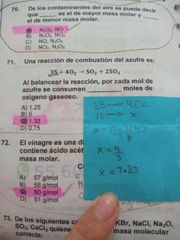
1.33
|
|
De los siguientes compuestos KBr, NaCl, Na2O, SO2, CaCl2 quienes presentan masa molecular correcta:
|
SO2: 64, NaCl:56, Na2O: 62
|
|
Los principales contaminantes del aire son N2O5, NO2 y NO, entonces, se puede afirmar que _______ es el de mayor masa molar y _________ es el de menor masa molar
|
N2O5 y NO
|
|
a las fuerzas intermoleculares que unen a las moléculas de agua se le denominan:
|
puentes de hidrógeno
|
|
propiedad del agua gracias a la cual un insecto puede caminar sobre ella:
|
tensión superficial
|
|
propiedad del agua gracias a la cual está sustancia sirve como regulador climático:
|
capacidad calorífica
|
|
las moléculas de agua tienen a orientarse en cierta posición en un campo eléctrico, y las moléculas de dióxido de carbono no lo hacen esto se debe a que la molécula de....
|
agua es polar
|
|
la conservación del clima y de las especies que habitan la tierra es gracias a qué propiedad del agua:
|
capacidad calorífica
|
|
¿Cuál de las siguientes sustancias es menos soluble en agua?
KBr NaNO3 (CH4) NaCl |
CH4
|
|
relaciona las propiedades
|
Ácido =
*sabor agrio *al reaccionar con metales liberan H2 gacioso Base= *son jabonosas *cambian el papel tornasol de rojo a azul *tienen sabor amargo |
|
las aminas se comportan como base de Lewis debido a:
|
que donan pares electrones
|
|
la baja ionización del ácido acético (CH3-COOH) indica que se trata de un ácido:
|
débil
|
|
fórmula química del ácido que conforma al vinagre:
|
CH3-COOH (C2,H4,O2)
|
|
al integrar a un circuito una disolución de HNO3 el foco del circuito enciende intensamente debido a que el HNO3 es:
|
electrolito fuerte
|
|
se dice que es un ácido fuerte porque el reaccionar con agua se ioniza completamente:
|
HCl
|
|
¿cuál de los siguientes valores de pH corresponde a la mayor concentración de iones OH?
|
13
|
|
¿Cuál de las siguientes sustancias es una base?
|
LiOH
|
|
Cuál de las siguientes sustancias es una base
|
LiOH
|
|
de los siguientes procesos ¿cuál no consume oxígeno?
|
flotación de minerales
|
|
la reducción es
|
ganancia de electrones
|
|
es la suma de todas las reacciones químicas necesarias para mantener la vida
|
metabolismo
|
|
los carbohidratos o azúcares son compuestos formados por carbono, hidrógeno, oxígeno, sintetizados a partir de _____________ y _____________ por los organismos fotosintéticos
|
CO2 - H2O
|
|
La información genética que tienen las células hijas resultantes de la mitosis es
|
igual a la progenitora
|
|
una planta homocigota para la forma de semillas lisa se representa con las letras _____________, lo que significa que tiene dos factores dominantes para esta característica.
|
AA
|
|
una alteración monogénica, la fibrosis quística se presenta en el 25% de los descendientes. Lo qué significa que el individuo que la padece solo la manifiesta si recibe un gen de cada uno de los progenitores los cuales no manifiesta la enfermedad lo anterior es un ejemplo de...
|
autosómica recesiva
|
|
para Darwin y Wallace el mecanismo evolutivo de mayor importancia es la
|
selección natural
|
|
Las garzas blancas que habitan en un pantano son ejemplo de
|
población
|
|
la reacción entre un ácido inorgánico con una base inorgánica, por lo general, se obtienen como productos:
|
sal y agua
|
|
una barra de metal oxidada es tallada con una lija si se obtienen 80g de Fe2O3 ¿ Cuál es la cantidad de sustancia en un mol que se obtiene?
|
0.5 mol
|
|
Se preparó una disolución de ácido acético y acetato de sodio de concentración: 0.1 M y pH = 5.0. Al agregar pequeñas cantidades de ácido clorhídrico se observó que el ph prácticamente no cambió. El comportamiento antes descrito se debe a que la disolución original es...
|
un buffer
|
|
identifica la reacción de sustitución
|
ZQ + R ➡️ ZR + Q
|
|
¿cuáles las siguientes sustancias es un carbohidrato?
|
almidón
|

¿ Qué cambio favorece la formación de productos para la siguiente reacción en equilibrio?
|
aumentar la temperatura del sistema
|
|
¿cuál de las siguientes reacciones químicas corresponde a una reacción de combustión?
|
2C3H2 + 9O2 ➡️ 6 CO2 + 2H2O
|
|
la hidrólisis de un disacárido produce
|
glucosa y fructosa
|
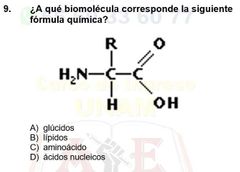
A qué biomolécula corresponde la siguiente fórmula química?
|
aminoácido
|
|
un cubo de hielo se coloca sobre una placa metálica y se derrite por una transferencia de energía. Para conocer qué cantidad de energía se transmite necesario conocer
|
Masa, calor específico, temperatura inicial y final
|
|
al calentar un gas ¿qué sucede con su volumen y energía interna?
|
aumenta
|

La siguiente ecuación química CH4+ O2 ---- CO2 + H2O con 🔼H = - 338 Kj
Representa una reacción: |
exotérmica
|

la reacción de descomposición
aumenta más rápido a recordatorio " A mayor temperatura es más rápida la reacción " |
70° C
|

la filtración es un método de separación qué se basa en :
|
salido inmiscibles en un líquido
|
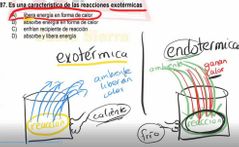
es una característica de las reacciones exotérmicas
|
libera energía en forma de calor
|

¿ Cuál es el número de oxidación del carbono CaCO3?
|
4 +
|

la configuración electrónica de cierto elemento es 1s² 2s² 2p⁴ para que quiera la configuración electrónica de un gas noble se debe:
|
adicionar dos electrones al orbital 2p⁴
|
|
¿Cuál es la biomolécula cuya función es de reserva para los organismos?
|
lípidos ----- grasas
reserva de energía a largo plazo. |
|
¿qué se necesita para aumentar la energía interna de un sistema?
|
incrementar la temperatura
|
|
Cuál de las siguientes sustancias es un compuesto
|
CO
|
|
científico que en la teoría atómica propuso que los electrones de un átomo están distribuidos en orbitales atómicos, girando alrededor de un núcleo positivo.
|
Rutherford
|
las siguientes compuestos KBr, H2S, HNO3 corresponden
|
sal binaria, hidrácido, oxiácido
|
|
principal contaminante del aire causante de la lluvia ácida
|
dióxido de azufre
|
|
el sodio metálico reacciona violentamente con el agua desprendiendo energía en forma de calor. ¿ qué tipo de reacción se tiene?
|
exotérmica
|
|
propiedades de los lípidos
|
*pueden ser ceras, esteroides y terpenos
*solubles en disolventes no polares |
|
en la naturaleza, el cloro presenta 2 isótopos estables. La diferencia entre ellos radica en el número:
|
neutrones
|

relaciona las propiedades
|
Ácido (H+)
*sabor agrio OH- *al reaccionar con metales liberan H2 gaseoso Bases *son jabonosas *cambian el papel tornasol de rojo a azul *tienen sabor amargo |
|
Elige la reacción para la formación del ácido nitrico
|
NO2 ➕ H2O ➡️ HNO3
|
|
enlace que une dos aminoácidos para formar una proteína
|
peptídico
|
|
las enzimas son ___________ que tienen la función de ____________ biológicos:
|
proteínas _____ catalizadores
|
|
para aumentar la energía interna de un sistema se debe
|
aumentar la temperatura
|

los cambios de la entalpía y la energía libre de Gibbs están relacionadas por la expresión:
(AG - AH - TAS ) mnemotecnia |
🔼G = 🔼H - T🔼S
|
|
cuál es el enlace que unen a los monomeros de un lípido
|
Ester
|
|
cuál es el enlace que unen a los monomeros de un lípido
|
Ester
|
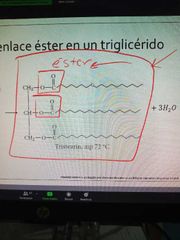
estructura de un lípido
|
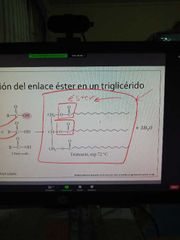
|
|
ácido carboxílico + amina =
|
Amida + agua
|
|
Enlace peptídico
|
une aminoácidos para formar proteínas
|
|
el enlace peptídico libera::
|
agua.
|

|
respuesta c
|
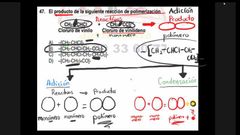
El producto de la siguiente reacción de polimerización
|
respuesta inciso B
|

Relaciona las siguientes columnas:
|
a- 1, b- ll, c- VI
|

Nombre el siguiente compuesto:
|
1,3 hexadieno
|
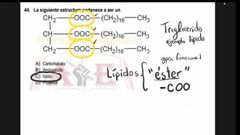
La siguiente estructura pertenece a ser un
|
lípido
|

Grupos característicos de un aminoácido
|
lll, V
amino (NH2) ácido carboxílico (COOH) |
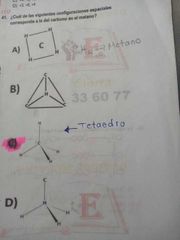
¿Cuál de las siguientes configuraciones espaciales corresponde a la del carbono en el metano?
|
inciso C
|

La fórmula general de un triglicérido es
|

|

Relaciona las siguientes columnas
|
a-l, b- lll, c- Vl
|
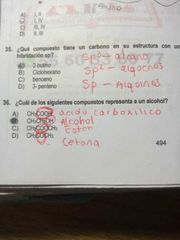
¿Cuál de los siguientes compuestos representa a un alcohol?
|
CH3CH2OH
|
|
¿Qué compuesto tiene un carbono en su estructura con una hibridación sp?
Sp³ -- alcano Sp² -- alquenos Sp -- alquinos |
2 - butino
|

cuál es su nombre común
|
respuesta C
|
|
El siguiente radical -O- pertenece a los
|
Éteres
|
|
Grupo funcional éter
|
-O-
|
|
Por cuántos carbonos está formada la glucosa
|
6 carbonos
|
|
los lípidos son
|
hidrofobicos
|
|
Los hidrocarburos están compuestos principalmente por
|
hidrógeno y carbono
|
|
La reacción de hidratación de alquinos produce
(Un alqueno cuando le agregamos agua producto un alcohol (- OH)) |
un alcohol
|
|
¿Cuáles son los productos de la combustión completa del etanol?
|
CO2 + H2O
|
|
Al hacer reaccionar ácido carboxílico con un alcohol, además de agua se obtiene
|
un éster
|
|
los científicos que descubrieron que la herencia radican los cromosomas y las leyes fundamentales de la genética fueron, respectivamente.
|
Thomas Morgan y Gregorio Mendel
|
|
los principios de la herencia en los que se basa la genética moderna fueron planteados por
|
Gregorio Mendel
|
|
número del par de cromosomas del cariotipo humano que presenta dimorfismo
|
par 23
|
|
la teoría cromosómica de Teodor Boveri y Walter Sutton, postulada en,1902 menciona que
|
el punto de reunión de las cromátidas es el cromosoma
|
|
¿Cuál de las siguientes alteraciones genéticas muestra un patrón de herencia ligada al sexo?
|
hemofilia
|
|
la carencia de un cuerpo de Barr en un cromosoma sexual significa que
|
donador es un individuo masculino
|
|
Se revisa el cromosomas en el microscopio encontramos un cuerpo de bar se trata de un cromosoma
|
de un individuo femenino
|
|
el albinismo es causado por un alelo autosómico recesivo. si un hombre y una mujer, normalmente pigmentados tienen un hijo albino , ¿Cuál es el genotipo del hijo?
|
homocigoto recesivo
|
|
son enfermedades producidas por una herencia ligada al sexo
|
hemofilia y daltonismo
|
|
las hembras zaras de Rusia tenía en hemofilia, es una enfermedad
|
liga al sexo
|
|
una mutación conlleva cambios en el _________ de un individuo y en ocasiones también se dan cambios a simple vista en su _________
|
genotipo - fenotipo
|
|
es la pérdida de una parte del cromosoma
|
deleción
|
|
una alteración monogénica, la fibrosis quística se presenta en el 25% de los descendientes. Lo qué significa que el individuo que la padece solo la manifiesta si recibe un gen de cada uno de los progenitores los cuales no manifiestan la enfermedad. lo anterior es un ejemplo de.
|
autosómica recesiva
|
|
la _____________ sirve para la evolución
|
mutación
|
|
la trisomía 21 se conoce cómo
|
síndrome de down
|
|
la mayor parte de las mutaciones son inocuas o neutras y son esenciales para la
|
evolución
|
|
proceso que promueve los cambios evolutivos de una especie
|
mutaciones al azar
|
|
la mayoría de las mutaciones son inocuas o neutras y son útiles para la
|
evolución
|
|
los dientes y plumas de archaeopterix, en comparación de aves y reptiles son una evidencia de
|
evolución
|
|
¿cuáles eran las características de la tierra primitiva?
|
erupción volcánica, tormenta eléctrica y oxígeno de carácter reductor.
|
|
relaciona las siguientes teorías con su descripción
|
Panspermia
las bacterias se originaron en otro planeta y sus esporas fueron trasladadas a la tierra por medio de meteoritos. Generación espontánea Los seres vivos se crearon a partir de materia inerte. Fisicoquímica La vida se originó en los océanos a partir de una serie de reacciones químicas entre elementos y compuestos simples. Creacionista los individuos fueron creados por la voluntad de un ser divino. |
|
La teoría quimiosintética sobre el origen de la vida firma que en la tierra primitiva ocurrió
|
la síntesis de materia en un ambiente abiótico, reductor, anoxigenico, con temperaturas elevadas, previo a su integración en las primeras formas de vida.
|
|
teoría que describe las condiciones que prevalecieron en la tierra primitiva, y qué explica cómo los factores físicos del medio propiciaron el proceso de evolución química para la formación de moléculas orgánicas complejas.
|
fisicoquímica
|
|
en la actualidad, es la teoría más aceptada sobre el origen de los seres vivos
|
quimiosintética
|
|
el aporte de Miller y Urey a la teoría de Oparin y Haldane fue demostrar la
|
síntesis abiótica de materia orgánica
|
|
la teoría quimiosintética formada por Alexander Ivanovich Oparin y John Burdon Sanderson Haldane permitió.
|
comprobar de manera experimental la materia orgánica evolucionó a partir de moléculas simples
|
|
relaciona las siguientes teorías con su descripción
|
Neodarwinismo
Selección natural, genética de poblaciones, deriva genética. Lamarckismo uso y deshueso, herencia de caracteres adquiridos Fijismo las especies son iguales desde su creación |
|
postuló que las mitocondrias y los cloroplastos proceden de bacterias que se hospedaron en una célula procarionte, la cual propósito
|
L. Margulis
|
|
teoría que explica el origen de los organismos membranosos
|
endosimbiótica
|
|
de las siguientes oraciones, ¿cuáles son aportaciones de la teoría evolutiva de Jean Baptiste Lamarck?
|
*la evolución es un proceso sucesivo
*los cambios en el organismo responden al ambiente |
|
propuso que las jirafas adquirieron su cuello largo por la herencia de caracteres adquiridos
|
Lamarck
|
|
la teoría de Lamarck sustenta qué:
|
la adaptación adquirida por los organismos se transmite su descendencia
|
|
según la teoría de la evolución de Lamarck los organismos
|
tienden a desarrollar los órganos que si utilizan
|
|
para Darwin y Wallace, el mecanismo evolutivo de mayor importancia es la
|
selección natural
|
|
Cuál delos siguientes enunciados corresponde a una de las premisas de la teoría evolutiva propuesta por Darwin - Wallace
|
las variaciones confieren distintas tasas de supervivencia
|
|
la teoría de la evolución propuesta por Darwin y Wallace precio de fundamentos _______ para explicarlas ___________
|
genéticos - variaciones
|
|
teoría más reciente de la evolución
|
neodarwinismo
|
|
la teoría sintética explica que la evolución es el fruto de la interacción de la selección natural y la...
|
variación genética
|
|
los estados larvarios que se estudian para establecer relaciones evolutivas son evidencias
|
embriológicas
|
|
área del conocimiento que aporta datos y permite entender que la evolución es cambio en la frecuencia, distribución y herencia de alelos dentro de una población
|
biogeográfica
|
|
se ocupa del ordenamiento de los organismos en grupos de especies semejantes
|
Taxonomía
|
|
categoría taxonómica que agrupa a los organismos según su nivel más particular
|
especie
|
|
se ocupa del ordenamiento de los organismos en grupo de especies semejantes
|
taxonomía
|
|
reinos que contienen organismos multicelulares y heterótrofos
|
fungi y animal
|
|
el siguiente organismo pertenece al reino protista
|
algas
|
|
según Woese, los dominios de la diversidad biológica son
|
arqueobacteria, eubacterias y eucarias
|
|
organismos multicelulares, heterótrofos, con células filamentosas, que habitan en lugares con poca luz y alta humedad, con reproducción sexual y asexual
|
hongos
|
|
El número de moles que contienen 147.1 g de dicromato de potasio (K2, Cr2, O7). Masa molar de 294.2 g/mol, es:
|
0.5
|
|
El vinagre es una disolución acuosa de ácido acético CH3 - COOH, Masa molar de 294.2 g/ mol, es:
|
0.5
|
|
El vinagre es una disolución acuosa de ácido acético CH3-COOH, ¿cuál es la masa molecular de este compuesto?
|
60 g/mol
|
|
Observa 2A + 3B ---- 2C + D
¿Por cada mol de reactivo B que se consume se obtiene del producto C? |
2/3 mol
|
|
¿Calcula la masa molecular del bicarbonato de calcio Ca (HCO3)2?
|
162
|
|
Una barra de metal oxidada es tallada con una lija y se obtienen 80g de Fe2O3¿ cuál es la cantidad de sustancia en mol que se obtiene?
|
0.5 mol
|
|
Referente a los siguientes ejemplos
CO, CO3,CO5 se puede afirmar que ... |
La masa molar del CO5 es la mayor y la del CO es la menor.
|
|
De los contaminantes del aire se puede decir que _____ es el de mayor masa molar y _____ es el de menor masa molar
|
N2O5, NO
|
|
Una reacción de combustión del azufre es:
3S ➕ 4O2 ➡️ SO2 ➕ 2SO3 Al balancear la reacción, por cada mol de azufre se consumen _______ moles de oxígeno gaseoso. |
1.33
|
|
El vinagre es una disolución acuosa la cual contiene ácido acético CH3-COOH calcula su masa molar.
C= 12, H = 1, O= 16. |
60 g/ mol
|
|
De los siguientes compuestos KBr, NaCl, Na2O, SO2, Cacl2, quiénes presentan masa molecular correcta:
|
SO2: 64, NaCl: 58, Na2O: 62
|
|
Los principales contaminantes del aire son N2O5, NO2 y NO, entonces, se puede afirmar que _____ es el de mayor masa molar y ______ es el de menor masa molar.
|
N2O5 y NO
|
|
A las fuerzas intermoleculares que unen a las moléculas de agua se le denominan:
|
puentes de hidrógeno
|
|
Propiedad del agua gracias a la cual un insecto puede caminar sobre ella:
|
Tensión superficial
|
|
Propiedad del agua gracias a la cual está sustancia sirve como regulador climático:
|
Capacidad calorífica
|
|
Las moléculas de agua tienden a orientarse en cierta posición en un campo eléctrico, y las moléculas de dióxido de carbono no lo hacen.
Esto se debe a que la molécula de... |
agua es polar
|
|
La conservación del clima y de las especies que habitan la tierra es gracias a qué propiedad del agua:
|
Capacidad calorífica
|
|
¿Cuál de las siguientes sustancias es menos soluble en agua?
|
CH4
|

Relaciona las propiedades
|
Ácido=
*Sabor agrio *Al reaccionar con metales liberan H2 gaseoso Base= *Son jabonosas *Cambian el papel tornasol de rojo a azul *Tienen sabor amargo Base = |
|
¿Cuál de las siguientes sustancias es un ácido fuerte?
|
H2SO4
|
|
Las aminas se comportan como base de Lewis debido a:
|
que donan pares de electrones
|
|
la baja ionización del ácido acético (CH3-COOH) indica que se trata de un ácido
|
débil
|
|
Ejemplos de ácidos fuertes
|
HCL y HNO3
|
|
Al integrar a un circuito una disolución de HNO3 el foco del circuito enciende intensamente debido a que HNO3 es:
|
electrolito fuerte
|
|
se dice que es un ácido fuerte porque al reaccionar con agua se ioniza completamente
|
HCl
|
|
¿Cuál de los siguientes valores de pH corresponde a la mayor concentración de iones OH?
|
13
|
|
¿Cuál de las siguientes sustancias es una base ?
(metal+ OH) |
LiOH
|
|
Clasifica cada una de las siguientes sustancias después de mezclarlas con agua NH2, CO2, CH4
|
base - ácido - neutra.
|
|
Una sustancia "X" tiene un PH de 8.65 ¿qué tipo de sustancia se obtiene?
|
básica
|
|
El agua de mar tiene un PH de 8.6, por lo tanto se dice que es
|
básico
|
|
Una disolución tiene un PH de 11, esto quiere decir que el soluto es:
|
básico
|
|
Si al medir el pH de una sustancia se obtiene un valor de 2, se dice que es:
|
ácida
|
|
si al medir el pH de una sustancia se obtiene un valor de 4 , se dice que es:
|
Ácido
|
|
Cuando el papel tornasol está en presencia de un ácido, ¿de qué olor se tiñe?
|
rojo
|
|
La fenolftaleína es un indicador ácido-base incoloro hasta pH= 8.2 y rosa cuando el pH es mayor a 10 ¿Cuál de las siguientes disoluciones dará un color rosa con la fenolftaleína?
|
NH3
|
|
A qué color cambia el papel tornasol cuando es sumergido en un ácido y una base
|
Rojo: ácido - Azul: base
|

Para valorar un ácido débil se utiliza una base débil para este proceso se utilizó un indicador Ácido- basé el cual coloreo de amarillo al ácido ¿cuál será el pH en el punto de equivalencia si se tienen una coloración roja?
|
6.4
|
|
a 70 °, la solubilidad del KCl es 50 g/L. En el laboratorio, hay un cubo de 100 cm³ de agua, a 70°, si se le adicionaron 100g del mismo soluto, se puede decir que la disolución:
|
está sobresaturada y sobra 50 g de KCl que no se disuelven
|
|
¿cómo se favorece la solubilidad de un soluto en un disolvente?
|
Aumentando la temperatura del disolvente
|

Relaciona los diagramas con los siguientes incisos
|
.
|

observa las siguientes imágenes que representan algunas disoluciones. imagína que las esferas representan las partículas de soluto en una determinada cantidad de agua. Con lo anterior clasifica las siguientes disoluciones:
|
.
|
|
¿Cómo aumentar la solubilidad de un soluto en un solvente?!
|
aumentando la temperatura
|
|
Una disolución contiene 2.5 g de cloruro de sodio ( NaCl) y 15 g del glucosa. Por tanto, el porcentaje en gramos de glucosa en esta disolución es:
|
12.8 %
|

.
|

.
|
|
se preparó una disolución de ácido acético y acetato de sodio de concentración: 0.1 M y pH= 5.0. La egresar pequeñas cantidades de ácido clorhídrico se observó que el pH prácticamente no cambió. El comportamiento antes descrito se debe a que la disolución original es...
|
un buffer
|
|
La solubilidad de una cantidad dada de un soluto en un disolvente aumenta.
|
al aumentar la temperatura
|
|
La regla empírica para la solubilidad de lo similar disuelve a lo similar, se refiere a las sustancias...
|
polares disuelven a polares y no- polares q no- polares
|
|
¿Cuál de las siguientes sustancias es menos soluble en agua?
|
metano
|